含有镁的合金广泛应用于航空航天领域,回答下列问题:
(1)取少量光亮的镁条于试管中,向其中加入稀盐酸,观察到 的现象可推断二者发生了化学反应。
(2)若验证镁与稀盐酸反应后的溶液中有盐酸剩余,下列实验设计可行的是 。
A.取生锈的铁钉于试管中,加入反应后的溶液
B.取少量反应后的溶液于试管中,滴加AgNO3溶液
C.取少量反应后的溶液于试管中,滴加稀氢氧化钠溶液
(3)向镁条中加入过量稀盐酸,完全反应后,再加入过量氢氧化钠溶液,生成5.8g氢氧化镁沉淀。
①写出加入氢氧化钠溶液时,生成氢氧化镁沉淀的化学方程式 ;
②计算镁条与稀盐酸完全反应后生成MgCl2的质量为 g。
化学就在我们身边,人类的衣食住行都离不开化学,根据图文回答问题。

(1)新疆长绒棉的色泽、细度、弹性、纤维长度等优于普通棉花,主要成分是(C 6H 10O 5) n,新疆长绒棉属于 (填"有机物"或"无机物"),新疆长绒棉与人造纤维相比优点是 ,可以采用 法来区分新疆长绒棉与人造纤维。
(2)"天问一号"探测器应用了世界上目前最轻的金属结构材料﹣﹣新型镁锂合金,该合金具有减震、消噪和抗电磁干扰性能。
①关于该材料,下列说法不正确的是 。
| A. |
该材料对电磁波有屏蔽作用 |
| B. |
该材料硬度很小 |
| C. |
该材料可有效的降低卫星发射时的噪音 |
②镁锂合金属于 (填"金属材料"或"合成材料")。
(3)铁锅易生锈,而铝锅抗腐蚀性能好,原因是 ;废旧铁锅、铝锅不要随意丢弃,应回收利用,这样做的意义是 。
(4)化石燃料的大量使用,带来了环境污染和资源枯竭等问题。共享汽车在广泛推广使用乙醇汽油,乙醇属于 (填"可再生"或"不可再生")资源。乙醇的化学式为C 2H 5OH,请写出乙醇完全燃烧的化学方程式 。
大量实验证明,化学反应符合质量守恒定律。
(1)如图是铁钉与硫酸铜溶液反应的实验。
①反应一段时间,观察到的现象是 ;
②该反应的化学方程式是 ;
③溶液中减少的铜元素质量等于反应生成的 的质量。
(2)取足量的铁、锌,各加入相同质量相同溶质质量分数的稀盐酸,完全反应后,铁、锌均有剩余,下列说法正确的是 。
| A. |
生成氢气的质量相等 |
| B. |
生成的氯化亚铁和氯化锌的质量相等 |
| C. |
参加反应的铁和锌的质量相等 |
| D. |
参加反应的稀盐酸中HCl的质量相等 |
(3)经计算3g镁和100g质量分数7.3%的盐酸充分反应可生成氢气0.2g,但经实验测定,生成氢气的质量大于0.2g,则可能的原因是过量的镁与 发生反应。

有限的元素可以组成种类繁多的物质,依据表中的元素回答下列问题。
| 元素名称 |
铜 |
钠 |
钙 |
氧 |
碳 |
氢 |
| 元素符号 |
Cu |
Na |
Ca |
O |
C |
H |
(1)常用作冶炼金属的还原剂是 (任写一种物质的化学式)。
(2)能使紫色石蕊溶液变红的有机物是 (写化学式)。
(3)战国《周礼》中记载"煤饼烧蛎房(即牡蛎壳)成灰",蔡伦将此"灰"溶于水即得碱。请写出蛎房烧成灰的化学方程式 。
(4)甲、乙、丙都是由以上元素组成的初中化学常见物质,其中甲为氧化物,它们之间有如图所示转化关系(部分反应物、生成物及反应条件已略去,"→"表示某一种物质经一步反应可转化为另一种物质)。
①若丙为黑色固体,则乙→丙发生反应的化学方程式为 。
②下列推断正确的是 (填序号)。
| A. |
a.甲只能为H 2O或CO 2 |
| B. |
b.乙可以为氧化物或碱、盐 |
| C. |
c.乙和丙不可能为同种类别的物质 |
| D. |
d.丙→甲发生的反应可能是化合反应或分解反应、置换反应、复分解反应 |

实验室利用如图所示装置进行相关实验,请回答下列问题:

(1)指出图中仪器g的名称 。
(2)实验室制取二氧化碳,发生反应的化学方程式 。
(3)实验室常用加热氯化铵和熟石灰的混合物的方法制取氨气,由于氨气极易溶于水,且密度比空气小,所选择的发生装置为 。
(4)如用F装置收集氢气,气体应从 进入。(填"a或b")
我国力争在2060年前实现"碳中和"(二氧化碳的排放与吸收平衡,实现"零排放"),保护环境。实现"碳中和"通常可采取如下措施:
(1)碳减排:使用氢能源汽车可以有效减少二氧化碳的排放。单质硼(B)可与物质X反应制取氢气,化学方程式为:2B+6X  2B(OH) 3+3H 2↑,则X的化学式为 ,B(OH) 3中B的化合价为 。
2B(OH) 3+3H 2↑,则X的化学式为 ,B(OH) 3中B的化合价为 。
(2)碳"捕捉"与封存:碳"捕捉"可用氢氧化钠溶液吸收空气中的二氧化碳,该反应的化学方程式为 。
(3)碳转化:一定条件下,可将二氧化碳在催化剂表面转化成某种有机清洁燃料,其反应原理如图所示,该反应的化学方程式为 。

下列有关叙述和对应的化学方程式均正确的是( )
| A. |
用含氢氧化镁的药物治疗胃酸过多症:MgOH+HCl═MgCl 2+H 2O |
| B. |
正常雨水显酸:CO 2+H 2O═H 2CO 3 |
| C. |
比较铜和银的金属活动性:Ag+Cu(NO 3) 2═Cu+AgNO 3 |
| D. |
乙醇燃烧:C 2H 5OH+O 2═CO 2+H 2O |
根据要求回答下列问题:
(1)生活中区别硬水与软水常用 ;
(2)电解水的实验中,H2与O2的体积比约为 ;
(3)酒精(C2H5OH)在空气中完全燃烧的化学方程式为 ;
(4)现有Br2+2NaI═I2+2NaBr、Cl2+2NaBr═Br2+2NaCl两个反应,其反应规律和金属与盐溶液的置换反应类似,则Br2、Cl2、I2三种非金属活动性顺序由大到小为 。
化学来源于生活又服务于生活,它在保护身体健康、能源、环境和材料等方面,为满足人类不断增长的物质、精神需求作出了巨大的贡献。请用所学的化学知识回答下列问题。
(1)生活中常用"加碘食盐"、"高钙牛奶"来补充人体所需的"碘"和"钙",这里的"碘"和"钙"应理解为 (填字母)。
| A. |
元素 |
| B. |
原子 |
| C. |
单质 |
(2)能供给呼吸的气体是 ,该气体进入人体后会与最基本的糖类物质葡萄糖发生反应,为人体活动提供能量。
(3)胃酸的主要成分是盐酸,胃舒平主要成分【Al(OH)3)】常用于治疗胃酸过多症,写出用胃舒平治疗胃酸过多症时的化学反应方程式 。
(4)长征五号火箭目前是中国运载能力最大的火箭,起飞推力超过1000吨,运载能力接近25吨。它使用由零下183℃的液氧和零下253℃的液氢为芯一级和芯二级发动机的推进剂,所以该火箭也被称为"冰箭"。将氧气和氢气转化为液氧和液氢的变化属于
变化,芯一级和芯二级发动机工作时发生反应的化学方程式为 ,使用氢气作为燃料的突出优点是 。
(5)2021年3月全国两会期间,政府工作报告中提到的"碳达峰"、"碳中和"成为热词。碳中和必须做好"加减法",一手减少二氧化碳等温室气体排放,一手发展碳捕集和封存技术等,实现排放量和吸收量的平衡。碳捕捉技术常用NaOH溶液来捕捉二氧化碳,工艺流程如图所示(部分条件及物质未标出)。捕捉室中发生反应的化学方程式为 ,该转化中循环使用的物质是 。

下列化学方程式与客观事实相符,且书写完全正确的是( )
A.用过氧化氢溶液制氧气:H2O2 H2↑+O2↑
H2↑+O2↑
B.铁丝在氧气中燃烧:4Fe+3O2 2Fe2O3
2Fe2O3
C.用稀硫酸除铁锈:Fe2O3+H2SO4═FeSO4+H2O
D.用澄清石灰水检验二氧化碳:CO2+Ca(OH)2═CaCO3↓+H2O
根据如图中的实验装置回答:
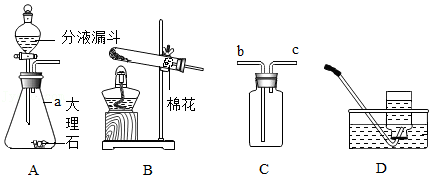
(1)仪器a的名称是 。
(2)用装置A制取CO2,分液漏斗中盛装的药品是 ;用装置C收集CO2,气体应从导管口 (填“b”或“c”)通入。
(3)用装置B制取O2,检查装置气密性的操作是 ,试管中反应的化学方程式为 。
(4)某同学在学习氮肥时,查阅资料:
①氨气极易溶于水,其水溶液称为氨水;
②氨水在浓度大或受热时易分解放出氨气。
实验室用生石灰和浓氨水能快速制取氨气的原因是 ;制得的氨气 (填“能”或“不能”)用装置D收集。
我国将力争2060年前实现碳中和。CO2的捕捉是减少碳排放的措施之一。
(1)一种利用NaOH溶液捕捉回收CO2的过程如图所示。
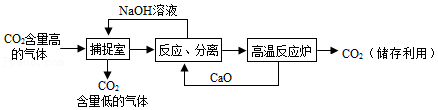
①捕捉室中NaOH溶液常喷成雾状,优点是 。
②“反应分离“环节发生的复分解反应是 (写化学方程式)。
③“反应分离”环节分离物质采用的方法是 。
④CO2用途广泛,写出一种用途: 。
(2)CaO固体也可以捕捉回收CO2。研究表明CaC2O4•H2O热分解制得的CaO疏松多孔,具有良好的CO2捕捉性能。取1.46g CaC2O4•H2O进行加热,固体质量随温度变化如图。
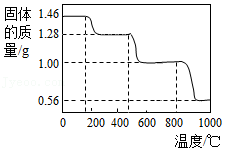
①写出400~600℃范围内分解反应的化学方程式: (CaC2O4•H2O的相对分子质量:146)。
②据图分析,CaO捕捉CO2的反应温度应 (填“高于”或“低于”)800℃。
阅读下列短文并回答问题。
氢在太阳中的核聚变放出大量光和热,是太阳能的来源,掌握可控核聚变技术对人类未来文明发展至关重要。2021年5月,中科院“人造太阳”EAST实验装置创造了氘、氚核聚变在1.2亿摄氏度下运行101秒的新纪录,为世界核聚变研究的发展作出巨大贡献。
氢气是高热值清洁燃料,目前主要通过电解水和天然气重整的方法获取氢气,其中天然气重整制氢的一种原理为:CH4+H2O CO+3H2,CO+H2O
CO+3H2,CO+H2O CO2+H2。氢氧燃料电池已被用作汽车驱动电源,H2和O2在电池内部(含有H2SO4或KOH等物质的溶液)发生反应产生电能。另外,CH4、C2H5OH等也可用作燃料电池的燃料,它们在燃料电池中的反应本质上与它们在O2中的燃烧相同。
CO2+H2。氢氧燃料电池已被用作汽车驱动电源,H2和O2在电池内部(含有H2SO4或KOH等物质的溶液)发生反应产生电能。另外,CH4、C2H5OH等也可用作燃料电池的燃料,它们在燃料电池中的反应本质上与它们在O2中的燃烧相同。
原子名称 |
质子数 |
中子数 |
核外电子数 |
氘(dao) |
1 |
1 |
1 |
氚(chuān) |
1 |
2 |
1 |
(1)氘、氚原子的构成如表,它们都属于氢元素的原因是 相同。
(2)上述短文出现的物质中,属于碱的是 (填化学式)。
(3)电解18g H2O理论上能获得 g H2。
(4)上述天然气重整制氢原理的两个反应中,化合价保持不变的元素是 。
(5)燃料电池工作时H2SO4溶液中起导电作用的离子是 (填化学符号)。
(6)CH4在O2中充分燃烧的化学方程式是 。
初步学会运用简单的装置和方法制取某些气体,是初中生化学实验技能应达到的要求。
(1)某学习小组将实验室制取常见气体的相关知识归纳如下。

气体 |
制取方法(或原理) |
发生装置 |
收集装置 |
O2 |
方法1:加热 |
均可选择A装置(可根据需要添加棉花) |
均可选择 装置(填代号) |
方法2:加热氯酸钾和二氧化锰的混合物 |
|||
方法3:利用过氧化氢溶液 |
均可选择 装置(填代号) |
||
CO2 |
反应原理:化学方程式为
|
(2)该小组同学将制取的O2和CO2(各一瓶)混淆了,设计如下方案进行区分。
实验方案 |
实验现象 |
实验结论 |
方案1:将带火星的木条分别伸入两个集气瓶中 |
若带火星的木条
|
则该瓶气体是O2 |
方案2:向两个集气瓶中分别滴入少量的 溶液,振荡 |
若溶液变浑浊 |
则该瓶气体是CO2 |
方案3:向两个集气瓶中分别倒入少量的水,振荡后再加几滴紫色石蕊溶液 |
若紫色石蕊溶液变 色 |
则该瓶气体是CO2 |
…… |
…… |
…… |
(3)实验室制取气体的过程主要包括:a.选择制取装置;b.验证所得气体;c.明确反应原理。你认为这3个过程的合理顺序应为 (填代号)。