在硫酸铜和硫酸亚铁的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤出的固
体中滴加稀硫酸,有气泡产生。下列判断不正确的是
| A.滤出的固体中一定含有铜 | B.滤出的固体一定含有铁 |
| C.滤液中可能含有硫酸铜 | D.滤液中一定含有硫酸锌 |
下列各组物质对应的鉴别方法正确的是( )
| A.黄金和黄铜--滴加稀盐酸 | B.双氧水和蒸馏水--观察颜色 |
| C.硬水和软水--观察是否澄清 | D.生理盐水和葡萄糖注射液--加紫色石蕊溶液 |
现有等质量的X、Y两种金属,分别放入浓度相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知X、Y在生成物中化合价均为+2价)。
则下列说法中错误的是
| A.生成氢气的质量:X﹥Y |
| B.金属活动性:Y﹥X |
| C.相对原子质量:X﹥Y |
| D.消耗硫酸的质量:X﹥Y |
为验证Zn、Cu、Ag的金属活动性顺序,下列实验方案中合理的是
| A.将Zn、Cu、Ag分别放入稀盐酸中 |
| B.将Cu、Ag分别放入ZnCl2溶液中 |
| C.将Zn、Cu、Ag分别放入AgNO3溶液中 |
| D.将Zn放入CuCl2溶液中,将Cu放入AgNO3溶液中 |
把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的甲、乙两种金属,反应后金属都没有剩余(反应后生成的化合物中金属都为+2价)。产生H2的质量随时间变化的趋势如图。下列说法不正确的是 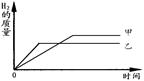
| A.乙的活动性比甲强 |
| B.甲的相对原子质量一定比乙小 |
| C.反应消耗等质量的硫酸 |
| D.反应消耗等质量的金属 |
甲、乙、丙、丁四种金属,其中只有甲可以在自然界中以单质形式存在,把乙、丙分别放入稀硫酸中,乙表面产生大量气泡,丙表面无现象,把丁放入丙的硝酸盐溶液中无变化,则四种金属的活动性顺序是
| A.乙>丙>丁>甲 | B.丙>乙>甲>丁 |
| C.丁>乙)丙>甲 | D.甲>乙>丙>丁 |
小明设计实验探究铁、铜、银三种金属的活动性顺序。他设计了四个实验方案,分别选择的试剂是:①铜、银、硫酸亚铁溶液;② 铁、银、硫酸铜溶液 ;③银、硫酸亚铁溶液、硫酸铜溶液 ;④铜、硫酸亚铁溶液、硝酸银溶液 。上述四个方案所选试剂正确的是
| A.①②③ | B.②④ | C.①②③④ | D.②③ |
下列实验设计能达到目的是
| 选项 |
A |
B |
C |
D |
| 实验设计 |
 |
 |
 |
 |
| 实验目的 |
证明二氧化碳与水反应生成碳酸 |
证明水是由氢元素和氧元素组成的 |
证明可燃物燃烧需要氧气与温度达到着火点 |
证明铁生锈是水和氧气共同作用的结果 |
右图所示是“水”中长“铜树”的探究实验。将一根质量为80g的铝丝(用砂纸打磨过)浸入硫酸铜溶液中,过一段时间取出附有铜的铝丝干燥后称量,其质量为94g。下列对实验中质量变化的分析正确的是
| A.通过反应生成铜的质量为(94-80)g |
| B.反应前后溶液的质量没有发生变化 |
| C.由于每个铝原子置换1个铜离子,所以(94-80)g是生成的铜与反应的铝的质量差 |
| D.反应后溶液的质量减轻了(94-80)g |
如右图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是
| A.向左偏 |
| B.向右偏 |
| C.先向右偏后向左 |
| D.先向左偏后向右偏 |
往 和 的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生.根据上述现象分析,你认为下面结论错误的是
| A. | 滤渣一定有 粉 | B. | 滤渣一定有 粉 |
| C. | 滤液中一定有 | D. | 滤液中一定有 |
向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为
| A.Ag、Cu两种单质的混合物 | B.Cu、Fe两种单质的混合物 |
| C.Ag、Fe两种单质的混合物 | D.Ag、Cu、 Fe三种单质的混合物 |
把金属X放人CuCl2溶液中有红色物质析出,放人MgCl2溶液中无现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是
| A.Mg、X、Cu | B.Cu、X、Mg | C.Mg、Cu、X | D.X、Mg、Cu |
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与 加入Zn的质量关系如图所示,下列说法正确的是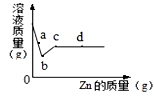
| A.a点溶液中的溶质有3种 |
| B.b点溶液是无色的 |
| C.若取b~c段溶液,滴加稀盐酸,有白色沉淀 |
| D.c点的固体中含有银、铜、锌 |
某同学设计了探究 、 、 三种金属活动性顺序的实验方案,仅用组内试剂,无法完成的是()
| A. | 、 、 、稀硫酸 | B. | 、 溶液、 溶液 |
| C. | 、 、 溶液 | D. | 、 、稀硫酸、 溶液 |