如图所示,一木块漂浮于X上,向X中缓缓加入(或通入)少量物质Y后,木块逐渐上浮,则X与Y可能是(溶液的体积变化忽略不计)
| 序号 |
① |
② |
③ |
④ |
| X |
水 |
氢氧化钙溶液 |
稀硫酸 |
硫酸铜溶液 |
| Y |
食盐 |
二氧化碳 |
镁粉 |
铁粉 |
A.①②③ B.②③④ C.②④ D.①③
小明学习了金属活动性顺序后,欲进一步进行实验探究,他将一小块金属钠投入CuSO4溶液中,看到了下列现象:有大量气体产生,并出现了蓝色沉淀,但没有红色物质析出.小明通过查阅资料,发现钠能与水反应,于是又补做了另一个实验,并记录如下:
| 操作步骤 |
实验现象 |
| ①将一小块钠放入盛水的烧杯中 |
金属钠在水面四处游动,并逐渐溶解,有大量气体产生 |
| ②向反应后的溶液中滴加酚酞试液 |
溶液变红色 |
| ③将产生的气体收集并点燃 |
气体燃烧,并产生淡蓝色火焰 |
分析:由上述现象可知:金属钠与水反应后,生成物中呈碱性的物质是 (选填“NaOH”或“Na2CO3”),其理由是 .
结论:据上述现象,Na投入CuSO4溶液中产生的蓝色沉淀是 .
反思:按金属活动性顺序,一种活动性较强的金属 (选填“能”、“不能”、“不一定能”)把另一种活动性较弱的金属从它的盐溶液中置换出来.
有等质量的镁和铁,二者都放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如图所示.下列说法错误的是
| A.反应后镁有剩余 | B.消耗的稀硫酸质量相等 |
| C.反应后铁有剩余 | D.产生氢气的质量相等 |
为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验,下列说法正确的是
| 实验1 |
实验2 |
实验3 |
 |
 |
 |
A.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响
B.对比实验①和③,可研究盐酸的浓度对反应剧烈程度的影响
C.对比实验②和③,可研究温度对反应剧烈程度的影响
D.对比实验①和③,可研究温度对反应剧烈程度的影响
下列可用于验证Fe、Cu、Ag三种金属的活动性顺序的一组药品是
| A.Fe、Cu、H2SO4溶液 | B.Cu、Ag、FeSO4溶液 |
| C.Fe、Ag、CuSO4溶液 | D.Ag、FeSO4溶液、CuSO4溶液 |
废液中含有AgNO3和Cu(NO3)2,工厂设计生产方案如图所示:

(1)加入的X、Y物质分别是 .
(2)写出①、③两步反应的化学方程式:第①步: ;第③步: .
(3)你认为此方案的生产目的是 .
有甲、乙、丙三种金属,甲能从丙盐溶液中置换出丙,将乙、丙投入到稀硫酸中,丙溶解而乙不溶解,则这三种金属的活动性顺序是.
| A.乙>甲>丙 | B.甲>丙>乙 | C.乙>丙>甲 | D.丙>乙>甲 |
以下四个图象能正确反映对应变化关系的是

① ② ③ ④
| A.①加热一定质量的高锰酸钾 |
| B.②电解水生成两种气体 |
| C.③相同质量的Mg、Al与足量的稀盐酸反应 |
| D.④木炭在密闭的容器内燃烧 |
下面是一些关于铁的实验研究,试按要求填空。
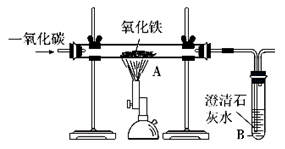
(1)模拟工业炼铁(装置图如右图):在硬质玻璃管内加入少量氧化铁粉末,先通入一氧化碳,排出装置内空气后,再用酒精喷灯加热A处药品。
① 硬质玻璃管内发生反应的化学方程式为: 。
② 试管B中发生反应的化学方程式为: 。
③ 该装置的主要缺点是 。
(2)铁锈蚀的探究
某化学兴趣小组进行家庭化学实验“探究铁锈蚀的原因”,设计如下图所示。他们预设的实验结果是仅有图Ⅲ中的铁钉生锈。但经过一周时间的观察,他们发现三支试管中铁钉都生锈了。
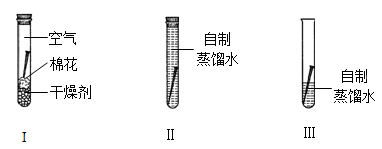
老师在听取了同学汇报后,做了如下实验帮助同学分析原因:取4份等量自来水样,经过不同的方法处理后,用数字传感器测定水样中的溶解氧,并进行如上图(Ⅰ、Ⅱ、Ⅲ)的实验。
水样溶解氧数据如下:
| 自来水 |
1号水样 |
2号水样 |
3号水样 |
4号水样 |
| 处理方法 |
不处理 |
煮沸 密封迅速冷却 |
煮沸 密封自然冷却 |
煮沸 敞口冷却 |
| 溶解氧(mg/L) |
5.37 |
0.52 |
0.66 |
3.44 |
[教师实验的现象记录(部分)]用2号水样进行的如图Ⅱ的实验中:一天后,铁钉有轻微生锈,从第二天到第七天,铁锈不再增加。
参考所给数据分析:①学生实验中:图Ⅰ中铁钉生锈的原因可能是 ;
图Ⅱ中铁钉生锈的原因可能是 。
②教师实验所记录的实验现象的原因可能是 。
用久置的镁条做实验时,需要用砂纸把表面的灰黑色打磨掉,直到露出光亮的银白色。实验小组同学对镁条表面“灰黑色外衣”的成分进行如下探究。
【提出问题】镁条表面“灰黑色外衣”的成分是什么?
【猜想与假设】
Ⅰ.是镁与空气中的氧气反应生成的氧化镁。
Ⅱ.是镁与空气中的二氧化碳反应生成的黑色碳单质。
Ⅲ.根据铜锈的成分是碱式碳酸铜,推测镁条表面的“灰黑色外衣”是镁在潮湿的空气中生锈得到的碱式碳酸镁。
同学们经讨论,从颜色上否定了只含有氧化镁,因为氧化镁是_____________。
【查阅资料】
① 碱式碳酸镁的性质有:受热可分解;常温下能与稀硫酸反应。
② 白色的硫酸铜粉末遇水能变为蓝色。
③ 碳不与稀硫酸反应,但与浓硫酸在加热条件下能反应并生成CO2、SO2和H2O。
同学们认为碳与浓硫酸反应生成三种产物的共同点是 (答出一点即可)。
【进行实验】
(1)同学们用久置的镁粉进行了如下实验。
| 实 验 装 置 |
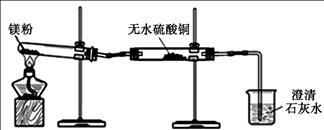 |
| 实 验 现 象 |
①无水硫酸铜粉末逐渐由白色变为蓝色 ②澄清石灰水变浑浊 |
| 结 论 |
久置的镁粉中除镁元素外,还含有的元素是 久置的镁粉中含有碱式碳酸镁 |
(2)同学们发现,经加热一段时间后,试管中镁粉会突然“噗”地燃烧起来,出现红热,很快停止,并有黑色固体粘附在试管壁上。
①将试管取下,冷却后加入足量稀硫酸,大部分固体溶解,并有气泡出现,但黑色固体没有消失。请写出有气体生成的一个反应化学方程式__________________。
②将实验①试管中的混合物进行_________________(填操作名称),除去其中溶液,向黑色固体中加入浓硫酸,加热。黑色固体全部溶解,得澄清溶液并伴有刺激性气味的气体产生。
实验(2)说明,镁在CO2中可以燃烧,生成了碳单质。
【实验结论】
综合上述实验现象,实验小组认为镁条表面“灰黑色外衣”中含有碳和碱式碳酸镁。
【反思与评价】
有的同学提出,实验(2)不足以证明镁条表面“灰黑色外衣”中含有碳,他的理由是_____________。
下列有关实验及其现象描述不正确的是
| A.红磷在氧气中燃烧产生大量白烟 |
| B.铁在空气中燃烧火星四射,生成黑色固体 |
| C.向盐酸中加入铁粉有气泡产生,溶液由无色变成浅绿色 |
| D.二氧化碳通入紫色的石蕊试液后溶液变成红色 |
铝铁铜银是常见的金属。
(1)铝比铁活泼,但铝在空气中比铁稳定,原因是 。
A.铝的密度比铁小
B.铝在地壳中含量比铁高
C.在空气中铝的表面能够形成一层致密的氧化膜
(2)许多金属都与酸反应,可制得氢气。请您写出锌与稀盐酸反应的化学方程式
现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B密度最小的气体,D为浅绿色溶液,G为蓝色溶液,它们之间存在如下关系:
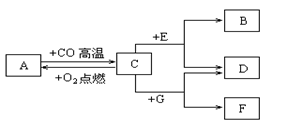
(1)写出下列物质的化学式:B 、F 。
(2)写出C→A发生的化学反应的方程式: 。
(3)写出一种与分别能D、E、G溶液发生置换反应的物质的化学式 。
有甲、乙、丙、丁四种颗粒大小相同的金属,分别投入等质量等浓度的稀硫酸中,乙、丙表面有气泡产生,且丙产生气泡较快;再将甲投入含丁的化合物的溶液中,甲的表面有丁析出,则这四种金属活动性顺序为
| A.甲>乙>丙>丁 | B.丙>乙>甲>丁 | C.丙>乙>丁>甲 | D.丁>甲>乙>丙 |