袋装食品中常用一种“双吸剂”保质,主要成分是铁粉和生石灰,同学们对一久置的双吸剂固体样品很好奇,设计了如下实验进行探究.
【提出问题】久置“双吸剂”的成分是什么?
【做出猜想】久置“双吸剂”中可能有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
【实验探究1】
取固体样品研磨,用磁铁吸引,磁铁上沾有黑色粉末,说明“双吸剂”中一定有 。再用磁铁反复吸引后,残留固体用于后续探究活动。
【实验探究2】
| 实验操作 |
实验现象 |
实验结论 |
| 取少量实验探究1的残留固 体放入试管中,加入蒸馏水 |
试管外壁不发烫 |
固体中一定没有 。 |
【实验探究3】
【实验结论】
步骤②产生白色沉淀,说明久置的“双吸剂”中含有 ,其反应的化学方程式: 。
步骤③有气泡冒出,溶液变为黄色,写出溶液变为黄色所发生的化学方程式 ;根据步骤③的现象,说明久置的“双吸剂”中含有 和 。
【实验探究4】
联想到生铁是铁和碳的合金,某同学对生铁又进行了如下探究。
(1)为测定某生铁粉末状样品中铁的质量分数,进行如下实验。设计如图所示装置,实验时首先检验该装置是否密封的正确操作是 。(填序号)
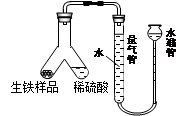
A.安装好装置并在量气管内加入水,上下移动水准管,若水准管中液面与量气管液面维持一定的高度差,说明装置密封。
B.安装好装置并在量气管内加入水,上下移动水准管,若水准管中液面与量气管液面始终相平,说明装置密封。
然后将生铁与稀硫酸放入Y型管中,塞紧橡皮塞。要使生铁样品与稀硫酸开始反应的操作方法为 (填字母序号)
A.将Y型管向左倾斜,使稀硫酸缓慢流入生铁样品中。
B.将Y型管向右倾斜,使生铁样品被缓慢倒入稀硫酸中。
实验结束后,根据量气管中的气体体积和密度,计算生铁样品中铁的质量分数,若测定的结果偏低,可能的原因是 (填字母序号)。
A.实验结束读数时未调节量气管和水准管中液面相平,立即读取气体体积
B.稀硫酸过量
C.反应结束未冷却到室温立即读数
(2)若称取11.5克生铁样品,放入装有100.0g稀硫酸的烧杯中恰好完全反应,在化学反应过程中对烧杯(包括溶液和残余固体,烧杯质量为60.0g)进行了四次称量
记录如表。
反应后所得溶液中溶质质量分数为多少?(结果精确到0.1%,写出计算过程,共2分)
计算过程:
| 反应时间 |
t0 |
t1 |
t2 |
t3 |
| 烧杯和药品的质量/g |
171.5 |
171.3 |
171.1 |
171.1 |
小明同学在学习酸的性质时,他用大小、外形均相同的铝片分别和H+浓度相同的稀盐酸、稀硫酸反应。他意外地发现:铝片与稀盐酸反应放出气泡的速度明显快于与稀硫酸反应放出气泡的速度。是什么原因导致了反应现象的差异呢?小明从微观角度分析得出,H+浓度相同的盐酸、硫酸中,只是所含 不同。
小明提出了如下猜想:
①Cl—能促进铝和酸的反应,SO42—对反应无影响;
②Cl—对反应无影响,SO42—能抑制铝和酸的反应;
③Cl—能促进铝和酸的反应,SO42—能抑制铝和酸的反应;
他进行了如下实验探究:
| 组别 |
相同的铝片 |
H+浓度相同的酸 |
反应片刻后添加某种试剂(少量) |
添加试剂后的反应现象 |
结论 |
| 1 |
1g铝片 |
5mL盐酸 |
Na2SO4 |
无明显变化 |
(填离子符号,下同) Na+和对反应无影响 |
| 2 |
1g铝片 |
5mL硫酸 |
NaCl |
明显加快 |
对反应有促进作用 |
针对上述探究过程回答下列问题:
(1)请你将表格中的空格补充完整;
(2)上述猜想 是成立的;
(3)若将第2组实验中添加的试剂NaCl改为HCl气体, (“能”填“不能”)完成探究任务。
除去下列物质中的杂质(括号内为杂质),所用试剂或方法不正确的是
| 选项 |
物质(杂质) |
除杂质所用试剂或方法 |
| A |
FeSO4溶液( CuSO4溶液 ) |
加入足量铁粉,过滤 |
| B |
Cu (Fe) |
溶液加入足量稀硫酸,过滤、洗涤、干燥 |
| C |
CO气体( CO2气体) |
依次通过氢氧化钠溶液和浓硫酸 |
| D |
Cu粉末(C粉) |
在空气中充分灼烧 |
欲测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为能测出铜的质量分数的是 合金;
(2)取该合金的粉末26g加入该硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,则

①生成气体的质量为 g.
②请计算:该合金中铜的质量分数;合金与酸恰好完全反应时所得溶液的溶质质量分数。
(写出计算过程)
如图所示,将一个塑料小球放入盛有硫酸铜溶液的烧杯中,小球漂浮于液面,将足量的铁粉投入到烧杯中,充分反应后,观察到铁粉表面有红色物质析出,写出有关反应的化学方程式 ;若溶液体积变化忽略不计,则塑料小球浸入液体中的体积跟原来相比 .

探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象.推测该气体可能是
| A.氢气 | B.二氧化硫 | C.二氧化碳 | D.一氧化碳 |
下列现象的描述正确的是
| A.磷在空气中燃烧,产生大量白色烟雾 |
| B.碳酸氢铵受热分解,生成白色固体 |
| C.铁在氧气中剧烈燃烧,火星四射,生成黑色固体四氧化三铁 |
| D.铁与稀硫酸反应有气泡产生,溶液由无色变成浅绿色 |
向CuO和铁粉的混合物中加入一定量的稀硫酸,微热,充分反应后冷却、过滤,在滤液中放入一枚洁净的铁钉,发现铁钉表面无任何变化。据此判断,下列结论正确的是
| A.滤液中一定含有FeSO4,可能含有H2SO4 |
| B.滤液中可能有CuSO4 |
| C.滤渣里一定有Cu,可能有Fe和CuO |
| D.滤渣里一定有Cu和Fe |
下列日常生活常见的金属中,金属活动性最强的是
| A.Fe | B.Cu | C.Al | D.Zn |
有甲、乙、丙、丁四种金属,仅甲在自然界中主要以单质的形式存在。丙盐的水溶液不能用丁制容器盛放,丁与乙盐的水溶液不反应。这四种金属的活动性由强到弱的顺序是
| A.甲>乙>丙>丁 | B.乙>丁>丙>甲 |
| C.丙>乙>甲>丁 | D.丁>乙>甲>丙 |
下列物质间比较的说法中不正确的是
| A.硬度:铜大于黄铜 |
| B.铁元素的质量分数:Fe2O3>FeO |
| C.熔点:武德合金小于铅(铅为武德合金成分之一) |
| D.铜和铁生锈的难易:铜比铁难 |
下列现象的描述错误的是
| A.木炭在氧气中燃烧发出白光 |
| B.铁丝在氧气中燃烧剧烈,火星四射,生成黑色固体 |
| C.铜丝在空气中加热变黑 |
| D.铁插入稀硫酸中溶液产生气泡,溶液变成蓝色 |
由下图所示实验得出的结论中,不正确的是

A B C D
| A.化学反应中有能量变化 |
| B.水是由氢气和氧气组成的 |
| C.红热的铁丝在氧气中能剧烈燃烧 |
| D.二氧化碳不支持燃烧,密度大于空气 |
铁是生产、生活中应用很广泛的一种金属。下列是与铁的性质有关的部分实验图,请回答下列问题。
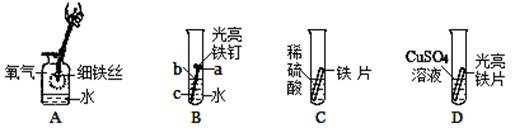
(1)A中发生反应的化学方程式是 ,集气瓶中水的作用是 。
(2)铁生锈的条件是 ,B中铁钉最易生锈的部位是 (填“a”、“b”或“c”)。
(3)C试管中刚好完全反应,得到溶液中溶质的化学式是 。
(4)D中反应一段时间后,现象是 ,试管内固体质量比反应前增大,据此推断,试管内溶液质量与反应前相比 (填“增大”、“不变”或“减小”)。