已知氯化镁样品中含有杂质氯化钠,某化学兴趣小组的同学通过以下实验测定其中氯化镁的质量分数:称取该样品15g溶于水得到溶液,然后将一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡(实验数据见下表)。
| |
第1次 |
第2次 |
第3次 |
第4次 |
| 加入氢氧化钠溶液的质量/g |
25 |
25 |
25 |
25 |
| 生成沉淀的质量/g |
2.9 |
x |
8.7 |
8.7 |
(1)表中x = 。
(2)求氢氧化钠溶液溶质的质量分数(写出计算过程)。
下面是实验室制取和收集气体的装置,根据所学知识回答下列问题: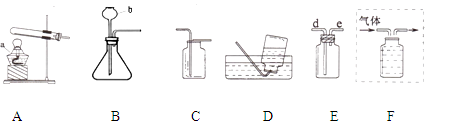
(1)写出仪器的名称:a ;b
(2)从上图中选择装置制取并收集干燥的CO2,应选用图中的 (填字母)。
(3)实验室若用装置E收集H2,气体应从导管的 (填“d”或“e”)端进入。
(4)若制取的O2用B装置制取的反应原理 ,用F装置排水法收集,请将图F补画完整(直接在图中画出)。
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应)。随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示。请完成下列计算内容:(写出计算过程)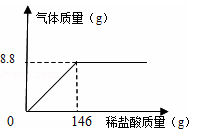
①样品中碳酸钙的质量分数是多少?
②所用稀盐酸溶质的质量分数是多少?
目前市场上的补钙药剂很多,下图是某品牌补钙药品的部分说明书.

为测定其含量是否达标,某兴趣小组的同学取10片钙片研碎后放于烧杯中,将100g稀盐酸分五次加入到烧杯中,并不断搅拌,称量,将得到的有关数据记录如下(钙片中其它成分不与稀盐酸反应):
| 加入稀盐酸的质量/g |
0 |
20 |
40 |
60 |
80 |
100 |
| 烧杯中剩余物质质量/g |
10 |
29.12 |
48.24 |
67.36 |
86.48 |
106.48 |
请你根据题给信息和表中数据,回答下列问题:
(1)实验过程中将钙片研碎的目的是: .
(2)完全反应后,产生二氧化碳的质量为 g.
(3)试通过计算说明,该品牌钙片含量是否达标.(写出计算过程)
(4)如果按用量服用,服用者每天通过该补钙剂摄入钙元素的质量为 g.
金属在生产和生活中具有广泛的应用。
(1)地壳中含量最高的金属元素是 (写元素符号,下同);人体中含量最高的金属元素是 。
(2)铁制品容易锈蚀,用稀盐酸除铁锈的化学方程式为 。
(3)铁矿石冶炼成铁是一个复杂的过程。把铁矿石、焦炭和石灰石一起加入 ,在高温下,利用其中反应生成的 把铁从铁矿石中还原出来。
(4)炼钢过程中,检验员提取5g钢样,在足量的氧气中充分燃烧,将生成的气体用足量的澄清石灰水充分吸收,得到0.25g白色沉淀。求:①该钢样燃烧时生成二氧化碳的质量;②该钢样中碳的质量分数。
(写出计算过程)
小华同学为了测定石灰石样品中碳酸钙的质量分数,取相等质量(14.0g)的五份样品分别和稀盐酸反应,其实验数据记录如下表。(杂质既不溶于水也不跟酸反应;不考虑二氧化碳在水中的溶解)通过对数据的分析和比较,回答下列有关问题:
| 盐酸的质量(g) |
10 |
20 |
40 |
60 |
80 |
| 二氧化碳质量(g) |
0.88 |
1.76 |
3.52 |
4.4 |
X |
(1)X的数值为 。
(2)7.4g氢氧化钙与 g碳酸钙含的钙元素质量相等?
(3)请在下图中画出在14.0g样品中加稀盐酸的质量与产生气体质量变化的函数关系示意图。
(4)石灰石样品中碳酸钙的质量分数是?(精确到0.1%)
将12.5g石灰石与足量稀盐酸充分反应,产生的二氧化碳的质量与时间关系如图所示(杂质不和盐酸反应,也不溶解)。
计算:①石灰石中所含碳酸钙的物质的量(根据化学方程式列式计算)。 (15)
②石灰石中碳酸钙的质量分数为 (16) 。
在2013年我市中考化学实验考试中,小华同学抽到的题目是“二氧化碳的制取和性质”。小华熟练地取一定量的石灰石与足量稀盐酸反应,产生二氧化碳气体。请计算小华制得1.76二氧化碳,至少需要80%的石灰石的质量(假设石灰石中杂质不与稀盐酸反应)。
将25 g石灰石放入烧杯中,加入100 g稀盐酸恰好完全反应(杂质不溶解,也不参加反应),此时烧杯中物质的总质量比反应前减少了8.8 g,计算:
(1)石灰石中碳酸钙的质量分数?
(2)生成物溶液中溶质的质量分数?(结果保留为0.1%)
(8分)某化学兴趣小组在室温的条件下(温度为20℃),为了测定H2SO4与NaOH发生中和反应时放出的热量,在左下图的小烧杯中加入8mL溶质质量分数为10%的NaOH溶液(密度1 g/mL),并滴入3滴酚酞,测量其温度;另取过量的稀硫酸(密度1.12g/mL),测量其温度后逐量缓慢地加入到小烧杯中,边加边用环形玻璃棒搅拌;测得烧杯中溶液温度的变化与加入稀硫酸体积之间关系如右下图所示。
(1)当加入5 mL稀硫酸时,溶液中的溶质有 (填写溶质化学式)。
(2)当加入约为 mL稀硫酸时,烧杯中溶液的温度达到最高。此时烧杯中溶液的温度约为(填写整数) ℃,烧杯中溶液颜色 。
(3)当加入稀硫酸的体积大于10mL时,溶液温度下降的原因是 。
(4)当溶液温度升到最高时,此时溶液中溶质质量分数是多少?(写出计算过程,共3分)
某化工厂怀疑采购来的烧碱有部分变质,工厂技术员为了测定其变质情况,即测定烧碱的纯度(假设样品中只有氢氧化钠和碳酸钠这两种成分,且碳酸钠是变质产生的),做了如下实验:取烧碱样品20g,分四次加入到36.5g一定浓度的稀盐酸中,数据如下表所示
| 实验次数 |
1 |
2 |
3 |
4 |
| 每次加入样品的质量/g |
5 |
5 |
5 |
5 |
| 反应后剩余物质的总质量/g |
40.4 |
44.3 |
m |
54.3 |
请根据提供的数据,回答下列问题:
(1)表格中m的数值为 。
(2)请计算烧碱样品中烧碱的纯度。
鸡蛋壳的主要成分是碳酸钙。为了测定某鸡蛋壳中碳酸钙的质量,小群同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取10 g 放在烧杯里,然后往烧杯中加入足量稀盐酸90 g,充分反应后,称得反应剩余物为97.8 g 。(假设其它物质不与盐酸反应)
(1)产生二氧化碳气体 g。
(2)计算该鸡蛋壳中碳酸钙的质量。
某补钙剂标签上对所含的成分有如下说明:每片含主要成分碳酸钙1.5g(相当于钙600mg)。某同学要探究该钙片的主要成分含量是否准确,他取出10片钙片,加入足量的稀盐酸,充分反应,收集到6.6g二氧化碳(假定其它成分不与盐酸反应)。试计算:
(1)每片含碳酸钙的质量是多少?
(2)每片含钙元素的质量是多少?
(3)通过计算,你得出什么结论?
有一种含水的过氧化氢(双氧水)样品10 g,在二氧化锰的催化作用下,完全分解得到3.2 g氧气,试求该样品中过氧化氢的质量分数。
某化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。请根据以上信息计算:样品中碳酸钙的质量分数?
实验中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。
请根据以上信息计算:样品中碳酸钙的质量分数?