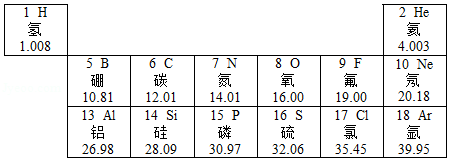
元素周期表是学习和研究化学的一种重要工具。如图是元素周期表的一部分。请回答下列问题:
(1)如图中的元素都属于 (填“金属”或“非金属”)元素。
(2)在周期表中查找硫元素,知道硫元素的原子序数是16,你还可以获得它的信息有 (写一条)。在化学反应中硫原子容易得到电子,形成 (用符号表示)。
(3)硒元素是人体必需的微量元素中的一种,摄入量过低可能引发 。

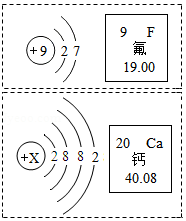
氟元素、钙元素对人体的主要作用是帮助构造骨骼和牙齿。如图是氟元素和钙元素的原子结构示意图,以及这两种元素摘自元素周期表的图示。其中x= ,钙的离子符号为 ,氟元素与钙元素形成化合物的化学式为 。葡萄糖酸钙【化学式Ca(C 6H 11O 7) 2】是一种促进骨骼生长的营养物质,葡萄糖酸钙由 种元素组成。
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:

(1)请从上表中查出关于氟元素的一条信息: 。
(2) 写出该结构简图的微粒符号 。
写出该结构简图的微粒符号 。
(3)第13号元素与第17号元素组成的化合物的化学式是 。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是 (填字母序号)。
A.Be和Mg B.C和Ne C.Al和Si D.F和Cl
溴原子结构示意图如图所示,请回答下列问题:
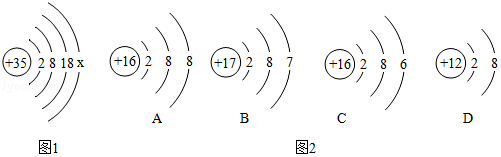
(1)图1中x的值为 。
(2)溴元素的化学性质与如图2中 (填字母标号)的化学性质相似。A、B、C、D属于 种元素。
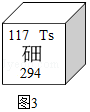
(3)第117号元素在元素周期表中的部分信息如图3所示,它与溴元素属同族元素,化学性质与溴元素相似,则第117号元素原子最外层有 个电子,原子中有 个质子。
(4)依据Fe+CuSO 4=FeSO 4+Cu,推断出Fe的金属活动性比Cu强,非金属也有类似规律,据此推断,在2KI+Cl 2=2KCl+I 2反应中,Cl 2的"非金属活动性"比I 2的 (填"强"或"弱")。
元素周期表是学习和研究化学的重要工具。溴元素的相关信息如图甲所示,请回答下列问题。
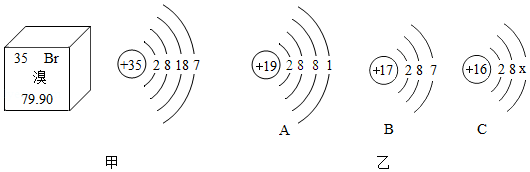
(1)溴的相对原子质量是 ,溴属于 (填"金属"或"非金属")元素。
(2)溴元素的化学性质与图乙中 (填字母)元素的化学性质相似。
(3)溴元素与图乙中A元素,形成化合物的化学式为 。
(4)若图乙中C表示离子,则x的值是 。
(5)在单质中元素的化合价为 ,因为元素的化合价是元素的 在形成化合物时表现出来的一种性质。
用适当的化学用语填空:
(1)地壳中含量最多的元素 ,它与地壳中含量最多的金属元素形成的化合物 ;写出空气中体积含量最多的物质,并标出元素化合价 。
(2)从①N②K③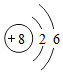 ④
④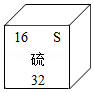 中,选择适当的元素写出符合要求的化学用语,一种复合肥 ;④形成的阴离子 。
中,选择适当的元素写出符合要求的化学用语,一种复合肥 ;④形成的阴离子 。
2019年是元素周期表诞生的第150周年,联合国大会宣布2019年是“国际化学元素周期表年”。 下面是元素周期表中1~18号元素原子核外电子排布:
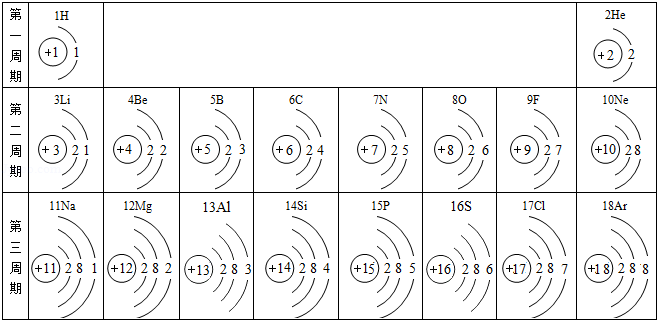
请回答下列问题:
(1)地壳中含量最多的金属元素原子核内质子数为 ,燃煤产生的两种氧化物易形成酸雨,组成这两种氧化物的元素中,原子序数最大的元素位于周期表中第 周期。
(2)第9号元素的钠盐常被添加到牙膏里以预防龋齿,该元素的离子结构示意图为 。元素X的原子核外电子总数为最外层电子数的3倍,单质X在空气中燃烧生成的化合物化学式为 。
(3)在元素周期表中,19号元素钾与钠位于同一族,则钾原子的电子层数为 ,金属钾与钠性质有许多相似之处,原因是 。
根据下列甲、乙图示和相关叙述,回答下列问题:
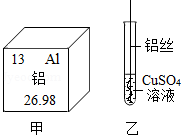
(1)图甲中铝元素的核电荷数为 ,相对原子质量为 。
(2)铝块能制成铝箔是利用了铝的 (填“延展性”或“导电性”)。
(3)图乙表示把一根用砂纸打磨过的铝丝插入硫酸铜溶液中,一段时间后,铝丝表面附着一层红色物质,溶液由蓝色逐渐变为无色,该红色物质是 (写化学式),由此实验可以得出金属活动性顺序:铝 铜(填“>”、“<”或“=”)。
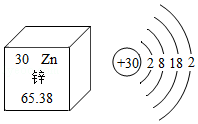
锌相对原子质量的国际新标准由张青莲教授主持测定。根据如图,回答下列问题:
(1)锌元素的相对原子质量为 ;
(2)锌元素属于 (选填“金属”或“非金属”)元素;
(3)锌原子在化学反应中容易 (选填“得到”或“失去”)电子。
在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
(1)构成氢气的粒子是 (填“氢分子”或“氢原子”)。
(2)根据如图1所示图示信息判断,下列说法正确的是 (填序号)。
A.硫属于金属元素
B.硫原子中的质子数为16
C.硫的相对原子质量为32.06g
(3)根据如图2粒子的结构示意图,回答问题。

①图2中粒子共表示 种元素(填数字)。
②A为氯原子的结构示意图,与氯原子的化学性质最相似的是 (填序号)。
(4)如图3所示为某化学反应的微观示意图。根据图示写出反应的化学方程式 。
1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了如下实验。他们用一束质量远大于电子的高速运动的α粒子轰击金箔,发现:“大多数α粒子能穿过金箔,一小部分发生偏转,极少数被反弹回来。”回答下列问题:
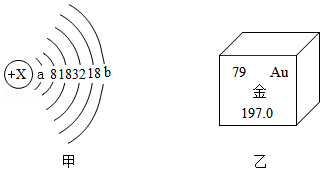
(1)1个α粒子由2个中子和2个质子构成,则α粒子带 电(填“正”或“负”),1个α粒子与1个He﹣4原子构成上的差别是 。
(2)甲图为金的原子结构示意图,乙图摘自元素周期表,据此推断a= ,b= 。
(3)根据实验现象中α粒子“大多数”与“极少数”的对比分析,你能想象出关于Au原子结构的结论是 。
如图是元素周期表部分元素的信息,根据所给信息按要求填空。
(1)写出一个三原子分子,且含有10个电子,俗称生命之源的物质的化学式 。
(2)写出一个四原子分子,且一个分子内有10个电子,溶于水,水溶液显碱性的气体的化学式 。
(3)写出三种第一元素组成的物质的化学式 。
(4)写出16号元素的离子符号 。
(5)一种金属氧化物当含少量Fe3+的杂质时,叫红宝石,当含少量Fe2+的杂质时,叫绿宝石,写出这种金属氧化物的化学式 。
观察如图粒子结构示意图和元素周期表(部分)。

(1)图甲中,具有相对稳定结构的原子是 (填元素符号)。
(2)图甲中,属于金属阳离子的是 (填离子符号)。
(3)图乙中,X的值为 。
(4)C和D两种元素形成化合物的化学式是 。
如图1A、B、C是三种粒子的结构示意图,D是钛元素在元素周期表中的信息。
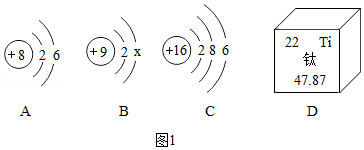
(1)若B表示原子,则x= 。
(2)A、C表示的微粒化学性质相似的原因 。
(3)钛广泛应用于航空、宇航以及医学上。D是钛在元素周期表中的信息。通过信息可知钛的相对原子质量。下列科学家对于测定相对原子质量作出卓越贡献的是 (填字母)。
