MgSO4•7H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3)为原料制备MgSO4•7H2O的主要流程如图:

已知:SiO2既不溶于水也不溶于稀硫酸。请回答下列问题:
(1)“操作a”的名称是 。
(2)“废渣Y”中含有少量的 FeOOH,其中铁元素的化合价是 。
(3)MgCO3溶于稀硫酸的化学方程式为 。
(4)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为 。
(5)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是 。
波尔多液含氢氧化钙、氢氧化铜和硫酸钙等物质,是农业上常用的杀菌剂。一种生产波尔多液的工艺流程如图。
(1)“煅烧”的化学方程式为CaCO3 CaO+CO2↑,该反应属于基本反应类型中的 反应。
(2)“混合”时不能用铁制容器,原因是 。
(3)“混合”时需不断搅拌,目的是 。
(4)“混合”过程中硫酸铜和氢氧化钙反应生成氢氧化铜的化学方程式为 。
(5)“混合”后得到的波尔多液温度明显高于室温,原因是 。
(6)用 可以测定波尔多液酸碱度。

过氧化钙( CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为Ca(OH)2,含少量CaCO3为原料制备CaO2的一种工艺流程如图1:

[查阅资料]
Ⅰ.Ca(OH)2+2NH4Cl=CaCl2+2NH3•H2O
Ⅱ.CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O↓+2NH4Cl
Ⅲ.CaO2•8H2O在水中不太稳定,会缓慢分解。
(1)“提取Ca(OH)2”时反应的基本类型是 ;Ca(OH)2的俗名为 ;“过滤1”所得滤渣的主要成分是 。
(2)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“二低”指的是:滤纸边缘略低于漏斗口、 。生产过程中为了精确测定溶液的pH,常使用 (填仪器名称)。
(3)在其他条件不变的情况下,制备CaO2•8H2O的反应时间(t)对其产率(w)的影响如图2所示。
①平均反应速率最快的时间段为: (填字母)。
a.0~10min b.10~20min c.20~30min d.30~40min
②30min后,w开始下降的主要原因是 。
(4)为了测定加入的NH4Cl溶液中溶质的质量分数,取30.00g NH4Cl溶液于烧杯中,加入稍过量的AgNO3溶液,完全反应后过滤、洗涤、干燥、称量,得到14.35g 白色固体。通过计算确定该溶液中NH4Cl的质量分数(精确到0.1%) 。
内江拥有中国西南地区最大的再生资源基地,可回收处理大量废旧塑料电器及玻璃等,某品牌电器的废旧电路板中含有Fe、Cu、Ag、Ni(镍,银白色金属) 等金属,如下图是某车间回收部分金属的工艺流程。已知,2Cu+O2+2H2SO4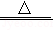 2CuSO4+2H2O。
2CuSO4+2H2O。
回答下列问题。
(1)操作①中,使用的玻璃仪器除烧杯、玻璃棒外,还需 ;
(2)滤渣③中含有的金属是 ;
(3)根据以上工艺流程图,可以得出Ni、Fe的金属活动性强弱顺序是Ni Fe(填“>”或“<”)。
(4)滤液③中加入足量铁粉的主要目的是 ,固体A除主要含有铜外,还含有一定量的铁,为了进一步提纯铜,可以向固体A中加入适量的稀硫酸,发生反应的化学方程式为 ;
(5)相比于直接焚烧废旧电路板回收金属,该工艺流程的主要优点是 。
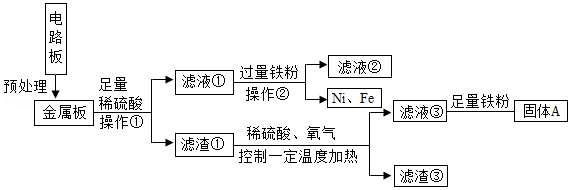
工业上,常采用“盐硝联产工艺”生产高纯度食盐,还可以制得硫酸钠。卤水中主要含有NaCl,还含有少量Na2SO4、CaSO4、MgSO4、CaCl2、MgCl2、FeCl3,用火碱和烟道气中的CO2为原料净化卤水,符合低碳经济发展要求。分析流程,回答问题:
(1)反应器1中主要除去的离子是 (填符号)。
(2)烟道气通入反应器2前要脱硫,是为了除去有害气体 (填化学式)。反应器2中生成沉淀的化学方程式 (写一个)。
(3)下表为NaCl和Na2SO4在不同温度时的溶解度:
温度/℃ |
0 |
10 |
20 |
30 |
32.4 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
溶解度/g |
35.7 |
35.8 |
36.0 |
36.3 |
36.4 |
36.6 |
37.0 |
37.3 |
37.8 |
38.4 |
39.0 |
39.8 |
4.9 |
9.1 |
19.5 |
40.8 |
52.0 |
48.8 |
46.2 |
45.3 |
44.3 |
43.7 |
42.7 |
42.5 |
从析盐罐中排出的溶液a,在温度不变的条件下,每10g水中含有NaCl约 g.为提高Na2SO4纯度,析硝罐中析出Na2SO4,需采用 (填“升温”或“降温”)结晶方法。
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.O2 Fe3O4 Fe
B.H2O2 H2 H2O
C.Ca(OH)2溶液 CaCO3 Na2CO3
D.CO2 CO H2CO3
甲、乙、丙三种物质的转化关系如图所示(“→”表示反应能一步实现,部分反应物、生成物和反应条件已略去)。回答下列问题:
(1)若甲是一种固态非金属单质,乙是一种可燃性气体,丙和乙的组成元素相同,写出乙→丙转化的化学方程式: 。
(2)若甲、乙的组成元素相同,乙是最常用的溶剂,丙是空气的主要成分之一,写出甲→丙转化的化学方程式: 。
(3)若甲、乙均为蓝色溶液,且乙可与AgNO3溶液反应生成不溶于稀硝酸的白色沉淀,丙为蓝色难溶于水的碱类物质,写出丙→乙转化的化学方程式: ,该反应的基本反应类型是 。

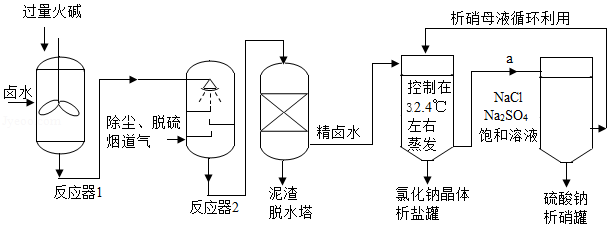
氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
22等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
23和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 |
氢氧化钠含量 |
碳酸钠含量 |
优等品 |
≥99.0% |
≤0.5% |
一等品 |
≥98.5% |
≤0.8% |
合格品 |
≥98.0% |
≤1.0% |
23的原因是 23,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
中国首款完全自主知识产权民用客机C919飞机的钛合金用量达9.3%.工业上利用钛白粉(主要成分是TiO2)制备海绵钛的工艺流程如图所示。下列有关说法不正确的是( )

A.反应中焦炭的作用可能是将TiO2还原生成Ti
B.反应Ⅱ中加入的物质X是Mg
C.反应Ⅲ属于分解反应
D.该工艺流程中,只有Cl2能循环使用
绘制知识网络是化学学习的一种有效方法,元素单质及其化合物的“价态—类别”二维图就是其中的网络图之一。如图是铁及其化合物的“价态—类别”二维图,下列有关说法或方程式正确的是( )
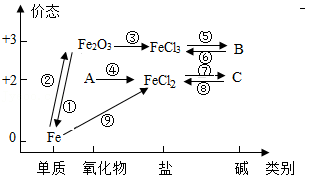
A.物质A的名称是氧化铁
B.①反应可能是Fe2O3+3Al 3AlO+2Fe
3AlO+2Fe
C.⑤反应可能是FeCl3+3NaOH═Fe(OH)3↓+3NaCl
D.⑤~⑨全部是复分解反应
某兴趣小组利用废镍材料(含有金属Ni及少量Fe、Ag)探究相关物质的性质并回收镍,设计流程如图所示(部分产物略去)
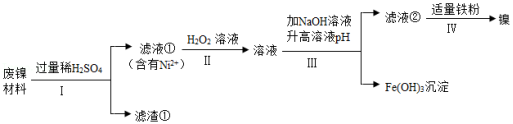
查阅资料:a.H 2O 2溶液可将Fe 2+转化为Fe 3+。
b.Fe 3+、Ni 2+转化为对应的氢氧化物沉淀时,溶液pH有如图关系:

(1)步骤Ⅰ的操作为 。
(2)滤渣①的成分为 。
(3)单质Fe参与反应的化学方程式为 (任写一个)。
(4)滤液②中有Ni 2+、无Fe 3+,则滤液②pH可能为 (填序号)。
A.pH=1
B.pH=2
C.pH=6
D.pH=10
(5)Ni、Fe、Ag三种金属的活动性由强到弱的顺序为 。
2021年6月8日是第13个“世界海洋日”。烟台有漫长的海岸线,蕴藏着丰富的海洋资源。某兴趣小组设计的综合利用海水的部分流程图如图。据如图回答:
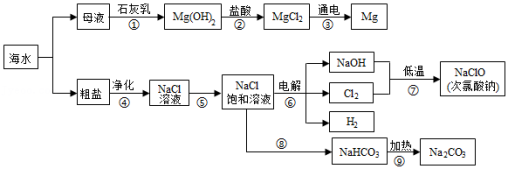
(1)海水制镁,步骤①②③是利用母液制镁的流程,该流程中发生中和反应的化学方程式是 。步骤①中制取氢氧化镁选择向母液中加入石灰乳,而不是向海水中直接加入石灰乳,原因是 。
(2)海水晒盐。通常采用 (填“降温”或“蒸发”)结晶的方法使海水中的氯化钠析出。通过步骤④除去粗盐溶液中含有的MgCl2、Na2SO4、CaCl2等可溶性杂质,需要依次加入过量的BaCl2溶液、过量的Na2CO3溶液、过量的NaOH溶液,然后过滤,在滤液中加入适量的稀盐酸。其中加入过量的Na2CO3溶液的目的是 。
(3)海水制碱。步骤⑧⑨是氨碱法制纯碱的流程,步骤⑧中需要向NaCl饱和溶液中先后加入的两种物质是 (写化学式)。步骤⑨中发生反应的化学方程式是 。
(4)步骤⑥是电解NaCl饱和溶液制取烧碱,该反应中的反应物是 。
(5)步骤⑦用烧碱低温制取次氯酸钠的反应原理为:Cl2+2NaOH═X+NaClO+H2O,则X的化学式是 。
无水氯化钙在工业上有广泛的用途。以石灰石矿粉(含有SiO 2、Fe 2O 3、MgSO 4等杂质)为原料,生产无水氯化钙的流程如图:
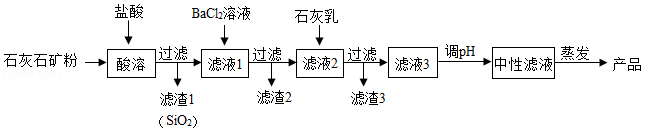
回答下列问题:
(1)从流程图中推知:SiO 2具有的化学性质是 。
(2)氧化铁与盐酸反应的化学方程式为 。
(3)滤渣3中除有Ca(OH) 2外,还有 (填化学式,下同)。
(4)产品中的杂质除极少量H 2O外,最有可能含的是 。