在实际生产中,常采用足量NaOH溶液来“捕捉”(吸收)CO2,部分流程图如图。

(1)大量CO2直接排放到空气中会导致 的加剧,破坏人类生存的环境。捕捉室内反应的化学方程式为 。
(2)操作①的名称 ,所用到的玻璃仪器有烧杯、玻璃棒和 。
(3)往纯碱溶液中加入X溶液,得到NaOH溶液和CaCO3,X的化学式是 。
(4)整个流程中可以循环使用的物质是 。
(5)若要确认“捕捉”后的气体中CO2含量已经降得很低,先分别取一瓶“捕捉”前和一瓶“捕捉”后的气体,接下来的实验操作是 。
图中的A~I表示几种初中化学常见的物质,其中A、D、I是氧化物,I是一种有毒气体;B元素在地壳中的含量位居第三;C由三种元素组成;G为紫红色。图中“一”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
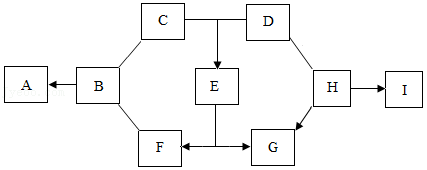
(1)写出G的化学式: 。
(2)写出B→A反应的化学方程式: 。
(3)图中各物质之间反应和转化反应中,没有涉及到的基本反应类型为 。
(4)H→I反应的化学方程式 。
海水提取粗盐后的母液还可用来提取金属镁,其流程如图:

回答下列问题:
(1)如在实验室进行操作a,使用玻璃棒的目的是 ,沉淀A的化学式是 。
(2)用贝壳生产石灰乳,发生反应的化学方程式有: 、 。
(3)由MgCl2溶液得到MgCl2•6H2O晶体,需要进行的实验操作有: 、 、过滤、洗涤。
(4)用203t MgCl2•6H2O晶体最多能制备金属镁 t。
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作补血剂。某硫酸厂产生的炉渣中除了有Fe2O3、FeO,还有一定量的SiO2.兴趣小组利用炉渣尝试制备FeCO3,其流程如图: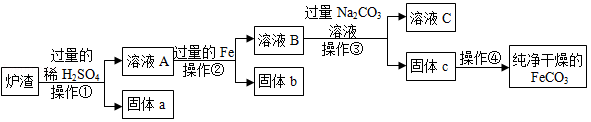
【已知:Fe+Fe2(SO4)3═3FeSO4;SiO2不溶于水,也不与稀硫酸反应】
(1)操作①的名称是 。
(2)溶液A中的溶质除H2SO4外,还存在 。
(3)上述流程中生成固体c的化学方程式 。
工业上以石灰石为原料制备碳酸钙的工艺流程如图1。
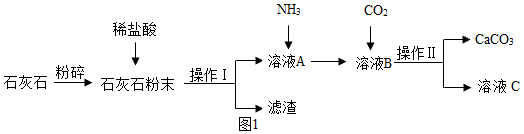
回答下列问题:
(1)石灰石粉末与稀盐酸反应的化学方程式是 。实验室发生该反应时,发生装置(如图2)应选用 (填字母序号,下空同),收集气体时应选用 。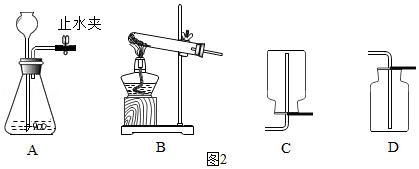
(2)操作Ⅰ和操作Ⅱ为同一操作,其名称是 。该操作需要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)溶液A中先通入NH3的目的是提供碱性环境,增大CO2的溶解量,促使反应进行。
①通CO2时,在溶液B中生成CaCO3,该反应的化学方程式是 。
②为使溶液B中的物质顺利转化为CaCO3,除了通NH3外,还可加入 (填字母序号)。
A.NaCl
B.NaOH
C.KOH
D.Ca(OH)2
孔雀石的主要成分是CuCO3•Cu(OH)2及少量不溶性杂质(杂质不与酸反应),某同学按下列实验步骤制取了少量氧化铜。

(1)白色沉淀的化学式为 。
(2)写出步骤③中发生反应的化学方程式 ; 。
(3)蓝色沉淀受热分解生成另一种氧化物的化学式是 。
(4)若向溶液A中逐滴加入NaOH溶液,其过程中溶质种数会发生变化,最多时可达 种。
无水氯化钙(CaCl 2)是重要的干燥剂,CaCl 2•6H 2O与冰的混合物是实验室常用的制冷剂,将CaCl 2•6H 2O加热可得CaCl 2.某工厂以石灰石为原料生产无水氯化钙的流程如图所示,原料石灰石中含有的杂质主要是MgCO 3、MgSO 4。

(1)过滤和蒸发均用到的玻璃仪器是 。
(2)石灰石溶解时,杂质MgCO 3发生反应的化学方程式为 ,该反应是 (填基本反应类型)
(3)加入BaCl 2溶液除去的杂质离子是 ,加入氢氧化钙溶液除杂的化学方程式为 。
(4)由CaCl 2•6H 2O得到CaCl 2是 变化(填"物理"或"化学")。
已知:向饱和食盐水中通入氨气得到饱和铵盐水,饱和铵盐水能与CO2发生反应:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl。某学习小组以饱和食盐水等为原料制备纯碱的主要流程如图:
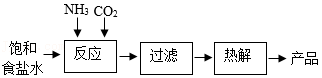
(1)常温时,饱和铵盐水的pH (填“=”或“>”)7。反应时,溶液中生成的NH4Cl中含有原子团的名称是 。
(2)过滤时,若经两次过滤滤液仍浑浊其原因可能是 (任写一条)。
(3)热解时,NaHCO3分解得到Na2CO3、CO2和H2O,该反应的化学方程式为 。
在抗击"新冠肺炎病毒"期间,消毒剂在公共场所进行卫生防疫时发挥着重要作用。二氧化氯(ClO 2)是一种高效、广谱、安全的杀菌消毒剂。以粗盐水(含可溶性杂质MgSO 4、CaCl 2)为原料,制取ClO 2的工艺流程如图:

(1)试剂A为 。
(2)加入过量Na 2CO 3溶液的作用是 。
(3)步骤④中发生反应的化学方程式为 。
(4)步骤⑤涉及的物质中含氯元素化合价最高的物质是 。
(5)如图流程中可循环利用的物质有 。
氯化亚铜CuCl是一种难溶于水和乙醇且在潮湿空气中易变质的物质,广泛应用于冶金、电镀、医药等行业、CuCl的制备流程如图:
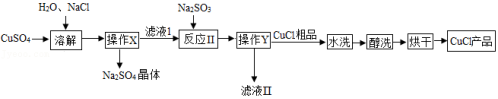
(1)"操作Y"名称是 。
(2)CuCl中铜元素的化合价为 。
(3)请配平"反应Ⅱ"的化学方程式: 。
(4)在"滤液Ⅱ"中可以循环利用的物质(水除外)是 。(填化学式)
(5)"醇洗"的目的是 ,防止后续过程中氯化亚铜变质。
2019年诺贝尔化学奖授予对锂离子电池研究作出贡献的三位科学家。如图是从钴酸锂废极片[主要成分为钴酸锂(LiCoO2)]中回收得到Co2O3和Li2CO3的一种工艺流程。
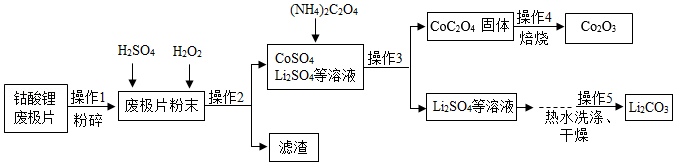
(1)操作1中,粉碎废极片的目的是 ;
(2)实验室中完成操作2时,需用到的玻璃仪器是 (填一种即可);
(3)操作4中,在高温条件下,CoC2O4在空气中反应生成Co2O3和二氧化碳,化学方程式为 ;
(4)操作5中,Li2CO3晶体用热水洗涤比用冷水洗涤损耗更少,说明Li2CO3的溶解度随温度升高而 。
工业上利用氟碳铈矿(主要成分为CeFCO3)提取CeCl3的一种工艺流程如图:

(1)流程中Ce(BF4)3转化成KBF4的基本反应类型是 。
(2)在足量氧气中高温焙烧CeFCO3,化学方程式为 。
(3)流程涉及的化合物中,铈元素的化合价为 价。
(4)酸浸过程中,CeO2与盐酸反应有刺激性气味的气体单质生成,且化学方程式中CeO2与盐酸的化学计量数之比为1:4,则化学方程式为 。
从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示:
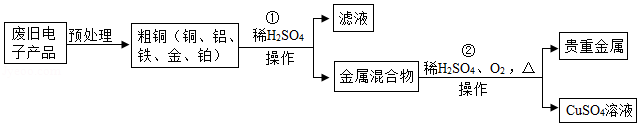
(1)图中“操作”的名称是 。
(2)写出所得贵重金属中任意一种成分的化学式 。
(3)写出①中发生的化学反应方程式 (任写一种);该反应的基本类型为 。
(4)写出②中发生的化学反应方程式 。
镁及其合金是一种用途广泛的金属材料,大量的金属镁是从海水或卤水中提取的,其主要步骤见如图:
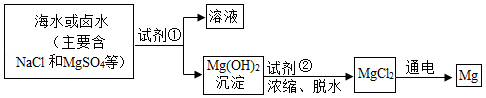
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用 ;
(2)加入试剂①后,分离得到Mg(OH)2沉淀的方法是 ;
(3)试剂②可以选用 ;
(4)通电后,MgCl2分解生成Mg和Cl2的化学反应方程式 。