某兴趣小组利用废镍材料(含有金属Ni及少量Fe、Ag)探究相关物质的性质并回收镍,设计流程如图所示(部分产物略去)
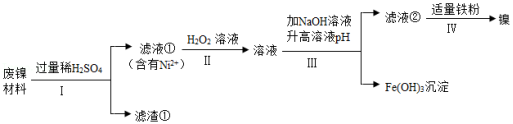
查阅资料:a.H 2O 2溶液可将Fe 2+转化为Fe 3+。
b.Fe 3+、Ni 2+转化为对应的氢氧化物沉淀时,溶液pH有如图关系:

(1)步骤Ⅰ的操作为 。
(2)滤渣①的成分为 。
(3)单质Fe参与反应的化学方程式为 (任写一个)。
(4)滤液②中有Ni 2+、无Fe 3+,则滤液②pH可能为 (填序号)。
A.pH=1
B.pH=2
C.pH=6
D.pH=10
(5)Ni、Fe、Ag三种金属的活动性由强到弱的顺序为 。
自贡市素有“盐都”美誉,盐化工比较发达,烧碱、纯碱、氯化铵等为其主要产品。某化工厂使用食盐和其它原料,采用侯德榜先生的联合制碱法生产纯碱,其主要化工流程如图:
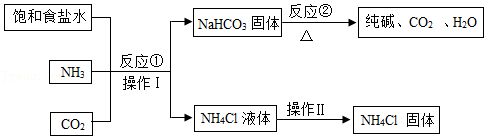
(1)操作Ⅰ的名称是 。
(2)反应②的化学方程式为 。
(3)从上述化工流程中看出可以循环使用的物质是 (填化学式)。
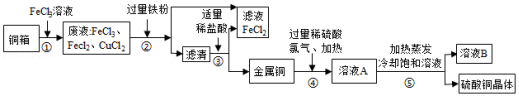
电子工业上制造铜电路板,常用30%的FeCl3溶液腐蚀镀铜电路板上的铜箔(Cu),如图是某兴趣小组设计的处理该生产过程中产生废液的流程图,据如图回答下列问题:
查阅资料:2Cu+2H2SO4+O2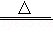 2CuSO4+2H2O;2FeCl3+Fe═3FeCl2
2CuSO4+2H2O;2FeCl3+Fe═3FeCl2
(1)步骤①所得的废液中只含有FeCl3、CuCl2、FeCl2三种溶质,据此可判断步骤①中铜与FeCl3反应生成的两种产物是 (写化学式)。
(2)步骤②中加入的铁粉与氯化铜发生反应的化学方程式是 ,步骤②还需要进行的实验操作是 。
(3)步骤③加入适量稀盐酸充分反应。当观察到 现象时,说明滤液中只剩下铜。
(4)步骤②③所得FeCl2可与一种气体单质发生化合反应生成FeCl3,实现循环使用,根据质量守恒定律可推测该单质是 。
(5)溶液B中含有的溶质是 。
2021年6月8日是第13个“世界海洋日”。烟台有漫长的海岸线,蕴藏着丰富的海洋资源。某兴趣小组设计的综合利用海水的部分流程图如图。据如图回答:
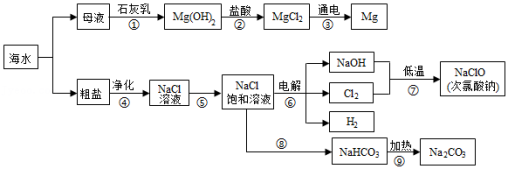
(1)海水制镁,步骤①②③是利用母液制镁的流程,该流程中发生中和反应的化学方程式是 。步骤①中制取氢氧化镁选择向母液中加入石灰乳,而不是向海水中直接加入石灰乳,原因是 。
(2)海水晒盐。通常采用 (填“降温”或“蒸发”)结晶的方法使海水中的氯化钠析出。通过步骤④除去粗盐溶液中含有的MgCl2、Na2SO4、CaCl2等可溶性杂质,需要依次加入过量的BaCl2溶液、过量的Na2CO3溶液、过量的NaOH溶液,然后过滤,在滤液中加入适量的稀盐酸。其中加入过量的Na2CO3溶液的目的是 。
(3)海水制碱。步骤⑧⑨是氨碱法制纯碱的流程,步骤⑧中需要向NaCl饱和溶液中先后加入的两种物质是 (写化学式)。步骤⑨中发生反应的化学方程式是 。
(4)步骤⑥是电解NaCl饱和溶液制取烧碱,该反应中的反应物是 。
(5)步骤⑦用烧碱低温制取次氯酸钠的反应原理为:Cl2+2NaOH═X+NaClO+H2O,则X的化学式是 。
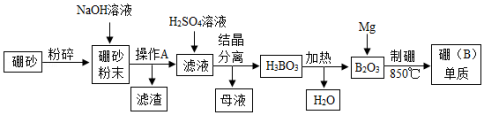
氮化硼(BN)陶瓷基复合材料在航天领域应用广泛。硼单质是制备氮化硼(BN)的原料之一,某工厂利用硼砂(主要成分为Na2B4O7•10H2O,杂质中含少量Fe3+)制备硼(B)单质的部分流程如图所示:
请完成下列问题:
(1)粉碎硼砂的目的是 。
(2)操作A的名称是 。
(3)滤渣的成分为 (填化学式)。
(4)写出H3BO3加热分解的化学方程式 。
(5)“制硼”反应的化学方程式为 。
某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如图所示:
请回答下列问题:
(1)工厂废液中加入过量A反应的化学方程式为 。
(2)用化学式表示固体甲的成分 。
(3)溶液甲中的金属离子是 (用离子符号表示)。
(4)完成步骤④的化学方程式:4Fe(OH)2+O2+2 ═4Fe(OH)3。
铝在地壳中主要以铝土矿的形式存在,铝土矿的主要成分为Al2O3(含有少量Fe2O3、SiO2等杂质)。工业上冶炼铝的工艺流程见如图:
(1)铝土矿中的SiO2不溶于水,也不与盐酸反应,操作①的目的是 ;
(2)操作③得到的Al(OH)3受热分解生成Al2O3,该反应的化学方程式为 ,铝土矿经过操作①~④的目的是 ;
(3)在冰晶石作助熔剂条件下,高温电解Al2O3得到金属铝,该反应的化学方程式为 。
工业上可以通过如图工艺流程处理工厂排放的含二氧化硫的尾气,并获得硫酸和氢气。

主反应器中发生反应的化学方程式为:SO2+2H2O+I2═H2SO4+2HI
请回答下列问题:
(1)该反应的物质中属于氧化物的有 。
(2)该反应前后,化合价发生变化的元素有碘和 。
(3)尾气中SO2的质量分数为10%,若吸收该尾气80t,理论上能够生产硫酸的质量为
t。
(4)在整个工艺流程中,能被循环利用的物质是 。
江西赣州被誉为“世界钨都”,钨(W)是一种重要的战略资源。如图是一种生产钨的工业流程:
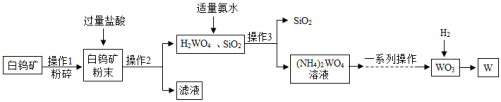
已知:白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2等;碳在高温条件下会与金属钨反应生成碳化钨。
(1)操作1中粉碎白钨矿的目的是 。
(2)操作2所得滤液中一定含有的阳离子是 、 。
(3)流程中氨水(NH3•H2O)和H2WO4反应生成(NH4)2WO4的化学方程式为 。
(4)用氢气还原WO3可获得高纯度的钨,此处不宜用焦炭代替氢气的原因是 。
(1)操作1中粉碎白钨矿的目的是增大反应物接触面积,加快反应速率;
(2)白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2,加入盐酸后二氧化硅没有参加反应,所以操作2所得滤液中一定含有的阳离子是Ca2+和过量的盐酸中的H+;
(3)反应物是NH3·H2O和H2WO4生成物是(NH4)2WO4,所以方程式是:2NH3·H2O+H2WO4═(NH4)2WO4+2H2O
(4)碳在高温条件下会与金属钨反应生成碳化钨,所以此处不宜用焦炭代替氢气。
海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如图。
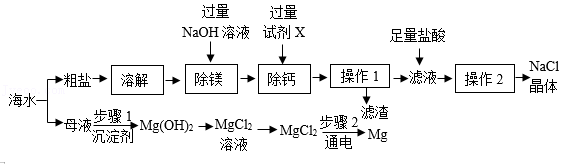
已知:粗盐中的杂质有泥沙、MgCl2、CaCl2,流程中部分操作及试剂已省略。
(1)试剂X的作用是除去粗盐中的Ca2+,则试剂X为 (填化学式)。
(2)“操作1”中玻璃棒的作用是 ,“操作2”的名称为 。
(3)滤渣中除泥沙外,还含有 。
(4)实际生产中,步骤1常选用 作为沉淀剂。
(5)步骤2需电解 状态的MgCl2以获得金属镁。
镁铝合金是重要的航天航空材料,如图是由废弃镁铝合金为原料来制备化工原料硫酸镁和硫酸铝的流程:
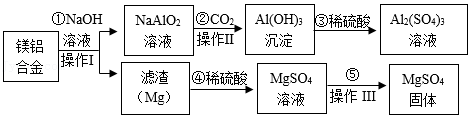
(1)操作Ⅰ的名称为 ,操作Ⅲ的注意事项为 。
(2)步骤③发生反应的化学方程式为 。
(3)某温度时,通过操作Ⅲ获取7.2g MgSO4固体,需取用25%的MgSO4溶液(密度为1.2g/cm3)的体积为 mL。
蔗糖是储藏在某些植物中的糖,日常生活中食用的白糖、冰糖的主要成分就是蔗糖,它是食品中常用的甜味剂。工业制备蔗糖的流程如图所示。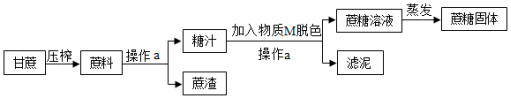
(1)操作a的名称是 。
(2)上述流程中物质M可能是 。
(3)在实验室进行蒸发操作时,要用到玻璃棒,其作用是 。
(4)蔗糖(C12H22O11)属于 (填“有机化合物”或“无机化合物”)。
2021年3月,三星堆遗址新出土重要文物500多件,有高2.62米的青铜大立人、高3.95米的青铜神树、象牙等,多属前所未见的稀世之珍。
(一)青铜古称“吉金”是金属冶铸史上最早出现的合金,青铜属于 (填“金属”或“合成”)材料,青铜的硬度比纯铜 (填“大”或“小”)。
(二)生活中铜制品长期露置在潮湿空气中会锈蚀,生成“铜绿”【化学式为Cu2(OH)2CO3】。
【查阅资料】Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O
【工艺流程】为从某锈蚀的铜样品中回收铜并制得硫酸锌,取该铜样品(除含有铜、锌和铜绿外,不含其它物质),进行如图操作:

请回答下列问题:
(1)气体a中含有H2和 (填化学式),溶液A的颜色为 色。
(2)操作Ⅰ的名称是 ,该操作中玻璃棒的作用是 。
(3)写出②中发生反应的化学方程式 (写一个即可),该反应属于基本反应类型中的 反应。
有限的元素可以组成种类繁多的物质,依据表中的元素回答下列问题。
| 元素名称 |
铜 |
钠 |
钙 |
氧 |
碳 |
氢 |
| 元素符号 |
Cu |
Na |
Ca |
O |
C |
H |
(1)常用作冶炼金属的还原剂是 (任写一种物质的化学式)。
(2)能使紫色石蕊溶液变红的有机物是 (写化学式)。
(3)战国《周礼》中记载"煤饼烧蛎房(即牡蛎壳)成灰",蔡伦将此"灰"溶于水即得碱。请写出蛎房烧成灰的化学方程式 。
(4)甲、乙、丙都是由以上元素组成的初中化学常见物质,其中甲为氧化物,它们之间有如图所示转化关系(部分反应物、生成物及反应条件已略去,"→"表示某一种物质经一步反应可转化为另一种物质)。
①若丙为黑色固体,则乙→丙发生反应的化学方程式为 。
②下列推断正确的是 (填序号)。
| A. |
a.甲只能为H 2O或CO 2 |
| B. |
b.乙可以为氧化物或碱、盐 |
| C. |
c.乙和丙不可能为同种类别的物质 |
| D. |
d.丙→甲发生的反应可能是化合反应或分解反应、置换反应、复分解反应 |

煤燃烧时产生的粉煤灰(主要成分为Al2O3、SiO2及少量Fe2O3等)也是一种可利用的资源。以粉煤灰为原料制取Al2O3的部分工艺流程如图:

【资料】
①SiO2既不溶于水也不溶于酸
②煅烧时发生的反应为:2AlCl3•6H2O Al2O3+6HCl+9H2O
Al2O3+6HCl+9H2O
(1)操作Ⅰ是 。
(2)写出“酸浸”步骤中盐酸与Al2O3发生反应的化学方程式 。
(3)“除铁”时发生的反应为FeCl3+3NH4HCO3═3NH4Cl+X↓+3CO2↑,X的化学式为 。
(4)流程中可循环利用的物质为 。
(5)高温烧结的Al2O3,又称人造刚玉,可用于制机械轴承、耐高温坩埚、高强度陶瓷等。由此可推知Al2O3性质为 (任写一种)。