“垃圾是放错的资源”。碘循环工艺不仅能吸收SO2,减少环境污染,而且还可以得到仅含一种元素的化工原料X,流程如图所示:

(1)流程中可循环利用的物质是 。
(2)膜反应器中发生的是分解反应,X的化学式是 。
(3)反应器中发生反应的化学方程式为 。
氢基熔融冶金技术是利用氢作为还原剂代替碳还原剂,从而实现减少CO2排放的目的,实现低碳冶金。氢基熔融还原生产高纯铸造生铁的主要流程如图所示(部分略去)。
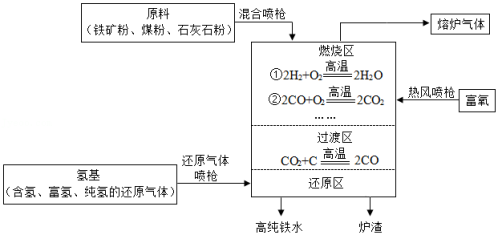
(1)燃烧区的作用是 ,燃烧区发生燃烧反应的物质还有 (填化学式)。
(2)还原区的反应除3CO+Fe2O3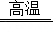 2Fe+3CO2,另一主要反应的化学方程式是 。
2Fe+3CO2,另一主要反应的化学方程式是 。
(3)从环境保护角度,与高炉炼铁技术相比,氢基熔融冶金技术的优点是 。
碳酸氢铵是一种常用的化学肥料。工业生产碳酸氢铵的一种流程如图所示:
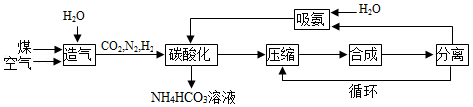
已知:“合成”步骤中发生的反应为N2+3H2 2NH3。
2NH3。
(1)碳酸氢铵属于化肥中的 肥。
(2)“造气”步骤中为加快反应速率,可采取的具体措施有 (写一条即可)。
(3)“碳酸化”步骤的化学方程式为 。该步骤在较低温度下进行的原因是 。
(4)“碳酸化”步骤的作用是制取碳酸氢铵和 。
(5)“循环”的目的是 。
金属材料在日常生活、工农业生产和科学研究中有着广泛的用途。
(1)钢铁是使用最多的金属材料。生铁和钢是含碳量不同的两种铁合金,其中生铁的含碳量 (填“大于”或“小于”)钢的含碳量。
(2)在钢中加入不同的合金元素可以提高其性能,例如,加入钨可以增强合金钢的耐磨性等。用黑钨矿制备钨的过程如图所示:

(注:钨酸是难溶于水的黄色固体。)
①钨酸钠中钨元素的化合价为 。
②填写下表。
步骤 |
化学方程式 |
基本反应类型 |
Ⅱ |
|
复分解反应 |
Ⅲ |
|
分解反应 |
Ⅳ |
|
|
在钢铁工业推进碳减排、碳捕集的过程中,化学发挥了重要作用。
(1)“焦炭炼钢”是先将铁精矿(Fe2O3)和焦炭同时加入高炉,鼓入热空气,充分反应后得到生铁,再将生铁转移至炼钢炉中炼制得钢。
①高炉炼铁的主要反应原理是在高温下, 夺取了Fe2O3里的氧将铁还原出来。
②某钢铁厂每年需要向高炉中加入120万吨的焦炭,若加入的焦炭全部转化为CO2,则该钢铁厂每年排放CO2的质量为 万吨。
(2)为了实现CO2的捕集利用,我国研制出一种多功能复合催化剂(含NaFe3O4),能将CO2转化为汽油,转化步骤如下:
CO2 CO
CO (CH2)n
(CH2)n 汽油
汽油
①步骤Ⅰ除生成CO外,还生成另一种氧化物。该氧化物的化学式是 。
②下列说法错误的是 (填字母)。
a.所得汽油中含有C、H两种元素
b.NaFe3O4中O为﹣2价,Fe为+3价
c.上述转化不仅有利于CO2减排,还可以减轻人类对化石能源的需求
(3)一种以“氢能炼钢”替代“焦炭炼钢”的工艺流程如图所示。

①高温下,用H2炼铁时反应的化学方程式为 。
②跟“焦炭炼钢”工艺相比,“氢能炼钢”的主要优点有 。
③从物质组成的角度,说明向炼钢炉中加入废钢的目的: 。
以黄铜矿(主要成分为CuFeS2)为原料,采用生物炼铜是现代炼铜的新工艺,同时还可以获得绿矾(FeSO4•7H2O),流程如图:
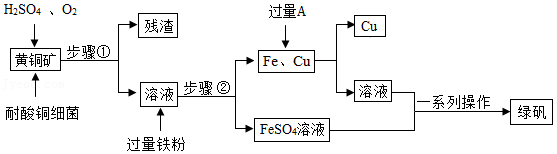
(1)步骤①中的化学方程式:4CuFeS2+17O2+2H2SO4 4CuSO4+2Fe2(SO4)3+ 。
4CuSO4+2Fe2(SO4)3+ 。
(2)步骤②中的反应有两个:反应一是Fe+Fe2(SO4)3═3FeSO4,该反应属于 (填基本反应类型),反应二的化学方程式为 。
(3)加入的A是 (填化学式)。
(4)获得绿矾的“一系列操作”为:蒸发浓缩、 、过滤等。
牙膏中常用碳酸钙粉末做摩擦剂,利用石灰石(杂质不溶于水和酸)制备纯净碳酸钙的一种方法如图。
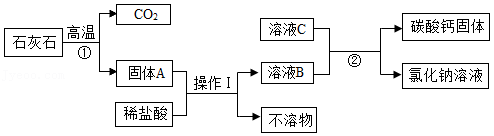
(1)反应①的化学方程式为 ;操作1的名称是 。
(2)反应②的化学方程式为 ,该反应属于 反应(填基本反应类型)。
(3)该方法中,用稀硫酸代替稀盐酸对制备碳酸钙是否有影响?判断并简述理由 。
(4)大气中CO2含量不断上升,会导致 。我国在联台国大会上提出:努力争取2060年前实现“碳中和”,请提出一条实现“碳中和”的措施 。
某燃煤电厂产生的固体废弃物粉煤灰中含有较多的氧化铝。从粉煤灰中提取氧化铝的工艺流程如图。
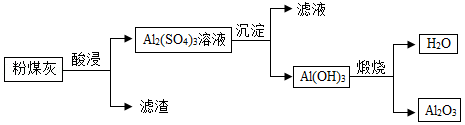
(1)“酸浸”中使用的酸是 (填字母序号)。
A.HCl
B.H2SO4
C.Na2SO4
(2)流程中涉及到的氧化物有 (写出1种即可)。
(3)“煅烧”过程发生反应的化学方程式为 ,反应类型是 。
(4)该工艺的价值在于 。
航空航天技术是一个国家科技、工业和国防实力的重要体现。南京理工大学陈光教授团队研究成功的"PST高温TiAl合金单晶"大幅度提高了耐高温性能,显著改善了材料塑性,对于新型轻质高温结构材料的发展和应用具有非常重要的意义。"PST TiAl单晶"实现了高强高塑的优异结合,持久寿命优于已经成功应用于GEnx发动机的4822合金1~2个数量级,有望将目前TiAl合金的使用温度从650~750℃提高到900℃以上,其抗压能力是第四代单晶合金的3倍,有了这种材料技术,中国也能够制造出世界一流的航空发动机。
(1)关于TiAl合金单晶的说法错误的是 。
A.TiAl合金属于单质
B."PST TiAl单晶"密度小、耐高温、强度大、可塑性强
C."PST TiAl单晶"持久寿命明显优于4822合金
D.钛和钛合金被认为是21世纪的重要金属材料,医疗上可用来制造人造骨等
(2)工业上常用铝土矿(主要成分为Al 2O 3,含Fe 2O 3杂质)为原料冶炼铝,工艺流程如图。请回答下列问题。
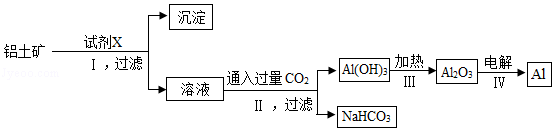
已知:氧化铝与酸、碱都能发生反应;
氧化铝与氢氧化钠溶液反应的化学方程式为Al 2O 3+2NaOH═2NaAlO 2+H 2O。
①试剂X是 (填"氢氧化钠溶液"或"盐酸"),反应Ⅰ后过滤所得的沉淀是 。
②Ⅱ中反应的化学方程式是 ;
③列举产物NaHCO 3的一种用途 ;
④电解氧化铝的化学方程式是 。
回收利用废旧金属具有重要意义。某机械厂金属废料的成分是Zn、Cu、ZnO和CuO,某化学小组利用该金属废料回收铜并制取氧化锌和硫酸铜。请回答下列问题。
【活动一】回收铜并制取氧化锌,实验方案如图:
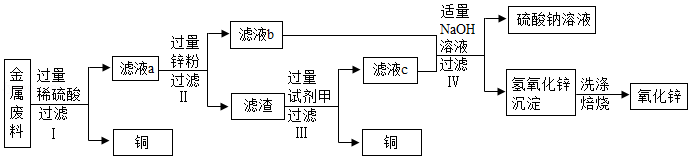
(1)步骤Ⅰ所得滤液a中溶质的成分是 (填写化学式)。
(2)步骤Ⅲ加入试剂甲的名称是 。
(3)步骤Ⅳ加入适量NaOH溶液的目的是 。
【活动二】利用活动一回收的铜制取硫酸铜,设计方案如下:
方案A:Cu CuO CuSO 4
方案B:Cu CuSO 4
【信息】Cu+2H 2SO 4(浓) CuSO 4+SO 2↑+2H 2O
(4)方案A中氧化铜与稀硫酸反应的化学方程式为 CuO+H 2 SO 4 = CuSO 4 +H 2 O 。
(5)小组同学从绿色化学的视角分析方案B不合理,理由是 (写出一条即可)。
工业上处理黄铜渣(Cu、Zn、ZnO、CuO和杂质)废料时,通常将其转化为硫酸锌和铜等有价产品。其主要流程如图所示(杂质不溶于水也不参与反应):
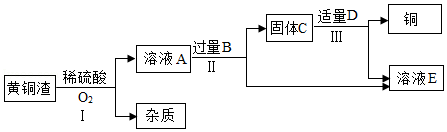
资料:2Cu+2H 2SO 4+O 2 2CuSO 4+2H 2O;ZnO+H 2SO 4═ZnSO 4+H 2O;CuO+H 2SO 4═CuSO 4+H 2O。
(1)物质B的化学式是 。
(2)过程Ⅱ中分离操作的名称是 ,该操作用到的玻璃仪器有烧杯、玻璃棒和 (填仪器名称)。
(3)过程Ⅲ中有气体产生,该反应的化学方程式是 。
我市著名的纸面石膏板企业,用热电厂燃烧煤产生的炉渣来生产石膏板.原理是:发电过程中产生的烟气中含有大量的SO 2,热电厂用"碱﹣石灰﹣石膏(CaSO 4•2H 2O)"的方法使烟气脱硫从而生成石膏.

(1)工业烟气没经处理直接排放到空气中易形成 ,会污染、破坏环境;
(2)写出吸收塔内发生反应的化学方程式 ;工业上用分离液态空气法制氧气,是利用空气中各成分的 不同进行分离的;
(3)化学反应类型有不同的分法,其中反应前后,有元素化合价变化的化学反应是氧化还原反应.有元素化合价升高的反应物是还原剂,有元素化合价降低的反应物是氧化剂.化学反应前后元素化合价没有变化的化学反应是非氧化还原反应.则下列说法正确的是
A、吸收塔、制碱釜中发生反应属于氧化还原反应
B、制碱釜中的反应物Na 2SO 3作氧化剂
C、氧化塔中发生的反应属于氧化还原反应
D、氧化塔中的反应物CaSO 3作还原剂
(4)生产流程中生成的 可循环利用,节约成本.
如图为某些物质间的转化关系,甲、乙、丙均为气体,乙有激性气味,丁是应用最广泛的金属。A是大理石的主要成分,G是一种化肥,H为红棕色固体。部分反应物和生成物已略去。
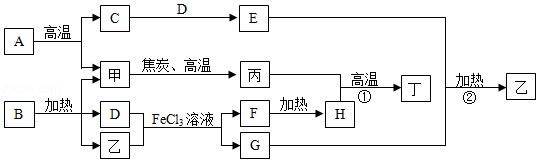
(1)化学式:B ,F 。
(2)自然界中,甲和D反应产生一种供给呼吸的气体,该反应名称为 。
(3)反应①、②的化学方程式:① ;② 。
(4)由反应②可知,在农业上施用G时应注意 。
某工厂产生的废渣主要成分是含钙的化合物(杂质为Fe 2O 3)。用该废渣制取CaCl 2晶体(CaCl 2•xH 2O)并进行组成测定,其制取的流程如图1所示:
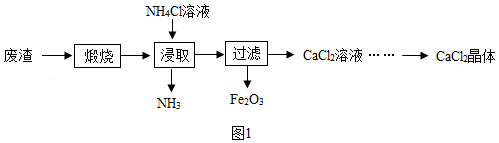
已知:NH 4Cl溶液显酸性,且浓度越高酸性越强
(1)XRD图谱可用于判断某固态物质是否存在。图2为煅烧前后废渣的XRD图谱。写出煅烧时发生的化学反应方程式 。

(2)浸取时需连续搅拌,其目的是 ;生成的NH 3能使湿润的红色石蕊试纸变 色。
(3)在其它条件相同的情况下,CaCl 2的产率随浸取温度的变化如图3所示。则宜选择的浸取温度为 ℃左右。
(4)若使用过量浓度较高的NH 4Cl溶液,则所得CaCl 2溶液中会含有NH 4Cl、 (填化学式)等杂质。
(5)过滤得到的Fe 2O 3在高温下可与CO反应,写出该反应的化学方程式 。
(6)测定晶体(CaCl 2•xH 2O)的组成:
a.称取14.7000g CaCl 2晶体于锥形瓶内,加入适量蒸馏水。使其全部溶解。
b.再向其中加入足量的Na 2CO 3溶液,静置。
C.过滤、洗涤、干燥、称量,得到10.0000g固体。
①通过计算,确定x的值(写出计算过程)。 。
②判断步骤b中沉淀完全的方法是:静置,向上层清液中滴加 ,则说明已沉淀完全;若沉淀不完全,则测得的x值比实际值 (填"偏大"、"偏小"或"不变")。