下列有关"物质﹣﹣性质﹣﹣用途"的叙述中,不正确的是( )
| 序号 |
物质 |
性质 |
用途 |
| A |
铁粉 |
与盐反应 |
可从废影液(含AgNO 3)中回收银 |
| B |
盐酸 |
与金属氧化物反应 |
焊接金属前,可用于除去金属表面的锈 |
| C |
熟石灰 |
与二氧化碳反应 |
用于检验气体是否是二氧化碳 |
| D |
小苏打 |
与火碱反应 |
可用于工业制食盐 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
下列物质间的转化只通过一步反应就能实现的是( )
| A. |
H 2O 2→H 2 |
B. |
NaCl→AgCl |
| C. |
Fe→Fe 2(SO 4) 3 |
D. |
CuO→Cu(OH) 2 |
除去下列物质中所含的杂质,所用的试剂和方法不正确的是( )
| 选项 |
物质 |
杂质 |
除杂所用试剂和方法 |
| A |
CO 2 |
水蒸气 |
通过浓硫酸 |
| B |
CuO |
Cu |
在空气中加热 |
| C |
KCl |
MnO 2 |
溶解、过滤、蒸发结晶 |
| D |
CaCl 2溶液 |
盐酸 |
加入适量的Na 2CO 3溶液 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
氯化铵是一种常见的化肥,其水溶液显酸性,下列有关氯化铵的说法不正确的是( )
| A. |
它是一种氮肥 |
B. |
可使农作物枝叶生长茂盛 |
| C. |
能与碱性肥料混合使用 |
D. |
用于熟石灰混合研磨的方法进行检验 |
如图,将胶头滴管中的物质X滴入装有物质Y的试管中,两物质充分反应。下列说法错误的是( )
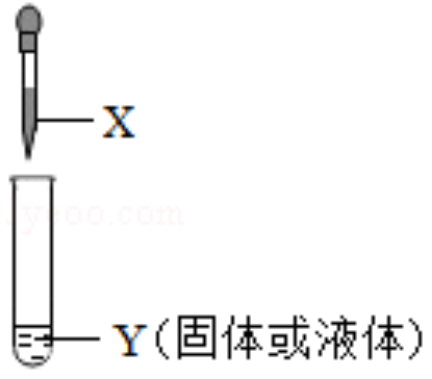
| A. |
X为稀硫酸,若反应有气泡产生,则生成的气体一定是H 2 |
| B. |
X为AgNO 3溶液,Y为Cu片,根据现象可判断金属活动性:Cu>Ag |
| C. |
X为BaCl 2溶液,Y为Na 2SO 4溶液,反应产生白色沉淀 |
| D. |
X为稀盐酸,Y为Al(OH) 3,该反应可应用于治疗胃酸过多症 |
小深同学用思维导图梳理了 Na 2 CO 3 的相关知识,其中描述错误的是( )
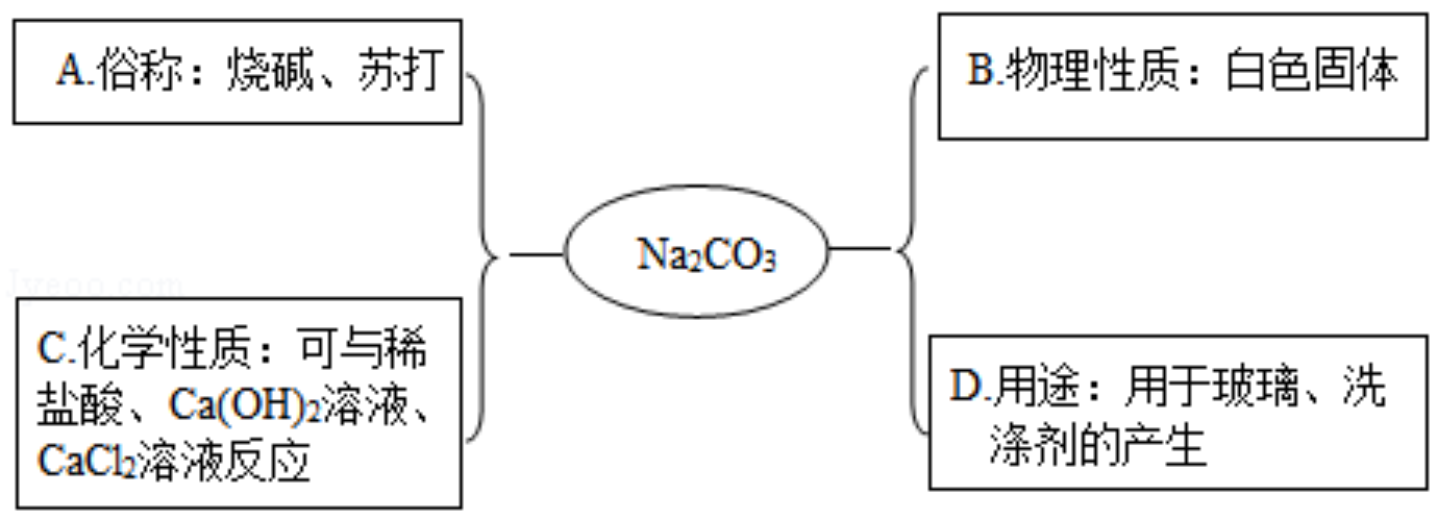
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
下列说法合理的有( )
①高炉炼铁炼得的是纯铁
②打开汽水瓶盖,看到气泡逸出,说明气体的溶解度随压强的减小而减小
③向充满CO 2气体的软塑料瓶中倒入半瓶水,拧紧瓶盖,振荡,塑料瓶变瘪,说明CO 2能与水发生反应
④某同学将一定量的Na 2CO 3和Ba(OH) 2溶液混合,要想检验反应后Ba(OH) 2是否过量,选用Na 2CO 3溶液、Na 2SO 4溶液或FeCl 3溶液均可
⑤向一定量的NaCl、MgSO 4和HCl的混合溶液中逐滴加入NaOH溶液,如图表示加入NaOH溶液的质量与某些物质的质量变化关系。则m点对应的溶液中有三种溶质,a可表示NaCl或H 2O的质量变化情况

| A. |
1个 |
B. |
2个 |
C. |
3个 |
D. |
4个 |
已知:①NaHCO3 固体受热分解 2NaHCO3 Na2CO3+CO2↑+H2O;②Na2CO3 受热不分解。回答下列问题:
(1)关于 NaHCO3 固体的叙述错误的是 (填标号)。
A.俗称小苏打 B.难溶于水
C.可与稀盐酸发生反应 D.是发酵粉的主要成分之一
(2)欲测定某 NaHCO3固体样品(只含Na2CO3杂质且分布均匀)中NaHCO3的质量分数,将 5.0g 该样品加热至质量不再改变,测得剩余固体的质量、生成CO2的质量随时间变化如图所示。
①NaOH溶液的pH 7(填“>”、“=”或“<”),用该溶液将生成的CO2完全吸收,发生反应的化学方程式为 。
②由图中数据可知,上述5.0g NaHCO3 样品完全分解产生CO2的质量为 g,产生H2O的质量是 g。
③计算该样品中NaHCO3的质量分数(根据化学方程式写出完整的计算步骤)。

在锥形瓶中加入80.0g质量分数为10%的硫酸铜溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净后在天平上称得质量为56.0g,再将盛有硫酸铜溶液的锥形瓶和铁钉一起放在天平上称量,记录所称得质量m 1.将上述铁钉浸到硫酸铜溶液中,待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和锥形瓶放在天平上称量,记录所称的质量为m 2。
(1)m 1 m 2(填">"或"="或"<")。
(2)锥形瓶的质量为 (用含m 1或m 2的代数式表示)。
(3)若硫酸铜反应完全,求此时所得溶液的质量(写出计算结果)。
现有一含NaCl杂质的Na2CO3样品,取13.9g样品溶于水,配成104.4g溶液,此溶液与100g某浓度的盐酸恰好完全反应,得到200g溶液。请计算:
(1)生成的二氧化碳的质量为 g;
(2)所得溶液中NaCl的质量分数(写出计算步骤)。
某碳酸钾样品中混有少量氯化钾杂质,取一定量样品于烧杯中,向烧杯中加入100g质量分数为7.3%的稀盐酸,此时恰好完全反应,将所得溶液蒸干得到18.1g固体,计算样品中碳酸钾的质量分数?(计算结果精确到0.1%)
为测定硫酸钠和硫酸镁固体混合物中硫酸镁的质量分数。某同学取固体混合物26.2g,向其中加入219.6g水,使其完全溶解配制成混合溶液。将200g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入到上述混合溶液中,生成沉淀的质量与加入氢氧化钠溶液的质量关系如下表:
| 次数 |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 氢氧化钠溶液质量/g |
40 |
40 |
40 |
40 |
40 |
| 产生沉淀质量/g |
1.45 |
2.9 |
m |
5.8 |
5.8 |
试分析计算。
(1)m的值为 。
(2)固体混合物中硫酸镁的质量分数。(结果保留0.1%)
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数。