学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其它物质省略),如图所示。请回答:
(1)若盐是硫酸钾,则①中发生反应的化学方程式为 。
(2)若盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有 (填序号)。
(3)若盐是硝酸铜,由⑦来实现的化学方程式为: 。
(4)图中⑤处应补充的文字是 (写一种,不能与图中已有信息重复)。

氧化锌软膏可用于急性或亚急性皮炎、湿疹、痱子及轻度、小面积的皮肤溃疡。闪锌矿(主要成分为ZnS)是含锌的主要矿物质之一,高温煅烧闪锌矿生成氧化锌和SO2,以氧化锌产品为原料制备纯氧化锌的生产工艺流程如图:
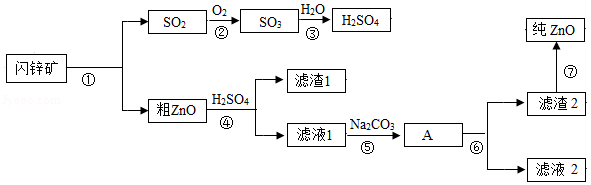
(1)已知A为碳酸锌和硫酸钠的混合物,则滤渣2的化学式为 。
(2)上述步骤中,步骤⑥的操作是 (填操作名称)。
(3)在上述步骤中,步骤 发生的反应属于分解反应。
(4)步骤④中发生的反应化学方程式为 (提示:ZnO与酸反应和Fe2O3与酸反应类似)。
已知:①NaHCO3 固体受热分解 2NaHCO3 Na2CO3+CO2↑+H2O;②Na2CO3 受热不分解。回答下列问题:
(1)关于 NaHCO3 固体的叙述错误的是 (填标号)。
A.俗称小苏打 B.难溶于水
C.可与稀盐酸发生反应 D.是发酵粉的主要成分之一
(2)欲测定某 NaHCO3固体样品(只含Na2CO3杂质且分布均匀)中NaHCO3的质量分数,将 5.0g 该样品加热至质量不再改变,测得剩余固体的质量、生成CO2的质量随时间变化如图所示。
①NaOH溶液的pH 7(填“>”、“=”或“<”),用该溶液将生成的CO2完全吸收,发生反应的化学方程式为 。
②由图中数据可知,上述5.0g NaHCO3 样品完全分解产生CO2的质量为 g,产生H2O的质量是 g。
③计算该样品中NaHCO3的质量分数(根据化学方程式写出完整的计算步骤)。
