粗盐中含有多种可溶性杂质(SO42﹣、Mg2+、Ca2+等)和难溶性杂质(泥沙等),以下是粗盐提纯思维导图,下列有关说法中不正确的是( )

A.①通过溶解、过滤操作,除去粗盐中难溶性杂质
B.②、③、④通过加入相应试剂沉淀杂质离子,是因为相应离子在溶液中不能大量共存
C.任意交换②、③、④中加入试剂的顺序并不影响杂质的除去
D.⑤加入适量稀HCl,调节溶液pH为7
粗盐中含有多种可溶性杂质(SO42﹣、Mg2+、Ca2+等)和难溶性杂质(泥沙等),以下是粗盐提纯思维导图,下列有关说法中不正确的是( )

A.①通过溶解、过滤操作,除去粗盐中难溶性杂质
B.②、③、④通过加入相应试剂沉淀杂质离子,是因为相应离子在溶液中不能大量共存
C.任意交换②、③、④中加入试剂的顺序并不影响杂质的除去
D.⑤加入适量稀HCl,调节溶液pH为7
除去粗盐中难溶性杂质后,得到的固体中除了NaCl还含有少量的可溶性杂质MgCl 2、CaCl 2,某同学为除去可溶性杂质,将该固体加水溶解形成溶液A,并设计如下方案 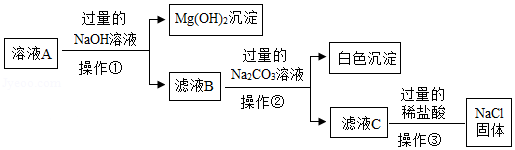
(1)操作①、操作②指的是 ;
(2)滤液B中的溶质是 ;
(3)操作③中加过量的稀盐酸是为了除去溶液中的 (填序号);
①NaOH ②Na 2CO 3③MgCl 2 ④CaCl 2
为除去粗盐中的泥沙、Ca2+、Mg2+、SO42﹣等杂质,可将粗盐溶于水,再进行下列五步操作:①过滤②加过量的氢氧化钠溶液③加适量盐酸④加过量的碳酸钠溶液⑤加过量的氯化钡溶液。正确的操作顺序是( )
A.④⑤②①③B.②④⑤①③C.②⑤④①③D.⑤②④③①
实验课上,老师知道某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
【实验名称】粗盐的提纯
【查阅资料】
1.粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质。
2.Ba(OH)2是一种易溶于水的强碱。
【主要玻璃仪器】量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯
【主要试剂】粗盐样品、稀盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液、蒸馏水
【实验过程】
步骤及目的 |
过程及说明 |
一、去除粗盐 中的泥沙 |
1.称取粗盐样品10.0g,用蒸馏水充分溶解 2.过滤去除泥沙得到溶液I 以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时: ;过滤时: 。 |
二、去除可溶 性杂质 |
将溶液I按如图流程图进行处理:
1、“加入过量氢氧化钠”时,发生反应的化学方程式是 。 2、过滤后,所得的滤渣成分有 种。 3、判断“稀盐酸适量”的方法是 。 |
三、获得产品 |
将溶液Ⅱ注入 (填仪器名称)中,蒸发结晶,观察到 ,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。 |
四、数据处理 |
该粗盐样品中氯化钠的质量分数是94% |
【结果与反思】
1.实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是 。
2.小明提出,如果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果也不会产生影响,你 (填“同意”或“不同意”)小明的观点。
海洋中有丰富的水生生物和化学资源。海水晒盐能得到粗盐和苦卤,粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。请回答下列问题。
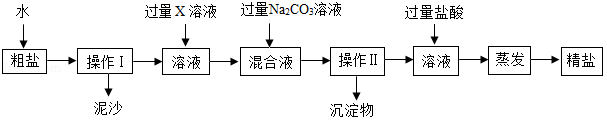
(1)蒸发过程中使用到玻璃棒,其作用是 。
(2)若要去除粗盐中可溶性的杂质氯化镁和氯化钙,可依次加入过量的X和碳酸钠两种溶液。下列物质中,可作为X的物质有 。
A、KOH
B、Ba(OH) 2
C、Ca(OH) 2
D、NaOH
(3)操作Ⅱ后向所得滤液中加入适量的盐酸,其目的是 ,最后通过蒸发结晶得到较为纯净的氯化钠。
生活由处处有化学,请根据所学知识回答下列问题:
(1)端午节是我们的传统节日,某种粽子使用糯米、火腿瘦肉、食盐和少量油为原料,你认为还缺少的营养素为 (除水以外);
(2)山药中含有碱性皂角素,皮肤沾上会奇痒难耐,你认为可涂厨房中的 (调味品)来止痒,请再列举一个与此原理相同的实例 ;
(3)某食品包中的白色干燥剂是 (写俗称),其干燥的原理为(用化学方程式表示) ;
(4)净水时用 来吸附水中色素和异味,生活中用 (操作名称)降低水的硬度;
(5)除去粗盐中难溶性杂质的实验操作步骤为①溶解② ③蒸发④计算产率。
粗盐含有少量的MgCl2,CaCl2,Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④B.③②①④C.①③②④D.③①②④
海水“晒盐”得到的粗盐,含有氯化镁、氯化钙、硫酸钠等可溶性杂质,必须对其进行分离和提纯,才能用于工业生产和人们的日常生活.某实验小组设计如下流程除去粗盐中的可溶性杂质,得到氯化钠晶体.请回答下列问题.

(1)步骤II加入的物质有:①过量的碳酸钠溶液、②过量的氢氧化钠溶液、③过量的氯化钡溶液,正确的加入顺序有三种,请你把它写出来(用物质前的序号表示),第一种: ;第二种: ;第三种: .
(2)步骤 IV的实验操作是 .
(3)工业上电解饱和氯化钠溶液可制得烧碱,同时还有氯气和氢气生成.该反应的化学方程式为 .
在粗盐难溶性杂质去除实验中,操作错误的是( )
A.称量时,在托盘天平左右两盘垫上相同质量的纸片
B.溶解时,用玻璃棒搅拌加快粗盐溶解
C.过滤时,用玻璃棒搅拌漏斗内的液体加快过滤
D.蒸发时,当蒸发皿中出现较多固体时停止加热
欲将粗盐提纯并用所得精盐配制一定质量分数的氯化钠溶液.下列说法正确的是( )
A.粗盐过滤时,用玻璃棒搅拌加快过滤的速度
B.蒸发滤液时,待蒸发皿中滤液蒸干时停止加热
C.配制溶液时必须使用的仪器有托盘天平、酒精灯、量筒、烧杯、玻璃棒等
D.配制溶液需要经过计算、称量、溶解、装瓶贴标签等步骤
粗盐中MgCl2、CaCl2等杂质,提纯粗盐的工艺流程如图所示。

回答下列问题:
(1)氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要用大量的水冲洗,再涂上 ;
(2)步骤②加入过量的碳酸钠溶液的作用是 ;
(3)操作a的名称是 ;
(4)步骤④中,要用玻璃棒不断搅拌,其目的是 。
食盐是生活中的必需品,但是通过海水晾晒得到的粗盐中往往含有可溶性杂质和泥沙等不溶性杂质而不能直接食用。某校化学兴趣小组的同学欲进行粗盐(含有难溶性杂质)提纯实验。同学们做粗盐提纯实验的操作示意图如图:

请回答下列问题:
(1)操作③的名称是 。
(2)操作④中用玻璃棒进行搅拌,其作用是 。
(3)操作⑤中有一处明显的错误,请你帮他们指出来 。
(4)粗盐提纯实验的正确操作顺序为 (填操作示意图的序号)。
(5)操作③中,当观察到 时,停止加热。
(1)如图所示为x、y、z三种固体物质(不含结晶水)的溶解度曲线,请回答下列问题:
① ℃时,物质x与物质z的溶解度相等;
②当x中含有少量y时,应采用 (填“降温结晶”或“蒸发结晶”)的方法提纯x;
③t3℃时将等质量x、y、z的饱和溶液降温到t2℃时,所得溶液中溶剂质量由小到大的顺序是 ;
④t3℃时将溶质质量分数为25%的x溶液降温至t1℃,所得溶液的溶质质量分数是 。
(2)在粗盐提纯时通常需要①溶解 ②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3 浴液③过滤④加入足量稀盐酸⑤蒸发结晶等操作来除去粗盐中的Na2SO4、MgCl2、CaCl2杂质以达到提纯的目的。
a.上述步骤①③⑤中都会用到的一种玻璃仪器是 ;
b,提纯的上述操作中共发生 个复分解反应。
