过氧化氢制备氧气可用多种催化剂。
(1)甲同学向过氧化氢溶液中加入二氧化锰固体制取氧气,相关数据如下:
反应前物质的质量/g |
充分反应后物质的质量/g |
|
过氧化氢溶液 |
二氧化锰 |
固体与液体混合物质量 |
100.0 |
0.2 |
97.0 |
计算:①该同学制得氧气的质量为 。
②该同学所用过氧化氢溶液中溶质的质量分数。
(2)乙同学发现CuSO4溶液对过氧化氢的分解也有催化作用。取相同质量分数的过氧化氢溶液100g于烧杯中,向其中加入溶质的质量分数为10%的CuSO4溶液20g,使过氧化氢完全分解。请计算,反应后所得溶液CuSO4的质量分数。(计算结果精确到0.1%)
某氯碱工厂用电解饱和食盐水制取烧碱,原理为:2H2O+2NaCl 2NaOH+H2↑+Cl2↑,另将生成的H2与Cl2恰好完全化合生成HCl制取浓盐酸。现将22.1t饱和食盐水电解完全(忽略水的挥发和气体的溶解),共收集到H2为0.1t。试计算:
2NaOH+H2↑+Cl2↑,另将生成的H2与Cl2恰好完全化合生成HCl制取浓盐酸。现将22.1t饱和食盐水电解完全(忽略水的挥发和气体的溶解),共收集到H2为0.1t。试计算:
(1)NaOH中质量分数最大的元素为 。
(2)电解后所得烧碱溶液的溶质质量分数(结果精确到0.1%)。
(3)制得溶质质量分数为36.5%浓盐酸的质量。
向盛有28g氯化钡和氯化钠固体混合物的烧杯中加入273.3g水,固体完全溶解。再逐滴加入一定质量分数的硫酸钠溶液,反应过程中生成沉淀的质量与所加硫酸钠溶液的质量关系如图所示。(化学方程式为:Na 2SO 4+BaCl 2═2NaCl+BaSO 4↓)
请计算:
(1)固体混合物中氯化钡的质量。
(2)恰好完全反应时,所得溶液中溶质的质量分数。

我市某地石灰石资源丰富,化学兴趣小组的同学为了测定该石灰石中碳酸钙的质量分数,用托盘天平称取了5份石灰石样品,分别加入各盛有200.0克稀盐酸的烧杯中充分反应(假设杂质不反应),得如下实验数据:
| 实验编号 |
1 |
2 |
3 |
4 |
5 |
| 石灰石样品的质量/g |
12.5 |
25.0 |
37.5 |
50.0 |
62.5 |
| 生成CO 2的质量/g |
4.4 |
7.5 |
13.2 |
17.6 |
17.6 |
分析上述实验数据并回答:
(1)实验编号为 的实验数据有明显错误。
(2)这种石灰石样品中碳酸钙的质量分数为 。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
在实验室中,某同学发现了一瓶敞口放置的氢氧化钙粉末试剂,并对其产生兴趣,进行如下实验。

根据实验过程和图象提供的信息,回答下列问题:
(1)完全反应后生成气体的质量是 g。
(2)b点溶液中的溶质为 (填名称)。
(3)求恰好完全反应时所得溶液中溶质的质量分数?(利用化学方程式进行计算,书写计算过程,结果精确到0.1%)
取一定量氯化镁溶液于烧杯中,将100g的氢氧化钠溶液平均分成五次加入烧杯中。在化学反应过程中对烧杯中的溶液和沉淀进行了多次过滤并称量。加入的氢氧化钠溶液和生成沉淀的质量关系记录如下表。
| 实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 加入的氢氧化钠溶液质量/g |
20 |
20 |
20 |
20 |
20 |
| 沉淀总质量/g |
2.9 |
5.8 |
8.7 |
11.6 |
11.6 |
分析上表中的数据,完成下列问题:
(1)第 次加完氢氧化钠溶液时,氯化镁和氢氧化钠恰好完全反应,此时生成沉淀质量为 g。
(2)恰好完全反应时,称量所得氯化钠溶液质量为168.4g,求原氯化镁溶液中溶质的质量分数(请写出计算过程)。
氯化钙钾石的化学式为KCl•xCaCl 2(x是CaCl 2的系数).它是一种天然的钾肥,溶于水后得到KCl和CaCl 2的混合溶液.某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解,得到KCl和CaCl 2的混合溶液.向该溶液中逐滴加入Na 2CO 3溶液,发生反应的化学方程式为:Na 2CO 3+CaCl 2═CaCO 3↓+2NaCl,产生的沉淀与加入Na 2CO 3溶液的质量关系如图所示.请回答下列问题:
(1)图中AB段表示的意义是 .
(2)①样品中CaCl 2的质量是多少?
②所用Na 2CO 3溶液中溶质的质量分数是多少?
(3)①样品中钾元素的质量分数是多少?(精确到0.1%)
②氯化钙钾石化学式中的x值是多少?
【要求:(2)、(3)两问写出计算过程】

某工厂利用废硫酸与废铁屑反应制取硫酸亚铁,现取废硫酸4.9t与足量的废铁屑反应,得到硫酸亚铁FeSO 4 1.52t。计算废硫酸中H 2SO 4的质量分数。
某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数,先将10g样品放入烧杯中,再把100g稀盐酸分5次加入该样品中(该实验条件下,杂质不与酸反应,也不溶解于水,忽略稀盐酸挥发),得实验数据如表格。
稀盐酸的质量 |
充分反应后剩固体的质量 |
第一次加入20g |
8g |
第二次加入20g |
6g |
第三次加入20g |
4g |
第四次加入20g |
2g |
第五次加入20g |
2g |
请计算;
(1)10g石灰石样品中碳酸钙的质量分数是 。
(2)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
某补钙片的主要成分为CaCO3,每片钙片重0.5g(假设钙片中其他成分不含钙元素,不溶于水且不与任何物质发生反应)。化学兴趣小组为测定钙片中钙元素的含量,进行了如图实验:
根据图示信息,完成下列各题:
(1)钙片中钙元素的质量分数为 。
(2)求恰好完全反应时所得溶液的溶质质量分数?(要求写出计算过程)
氯可形成多种含氯酸盐,广泛应用于杀菌、消毒及化工领域。实验室中制备KClO3的化学反应方程式为3Cl2+6KOH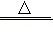 5KCl+KClO3+3H2O。若用Cl2与200g的KOH溶液恰好完全反应,反应后溶液质量为221.3g。计算:
5KCl+KClO3+3H2O。若用Cl2与200g的KOH溶液恰好完全反应,反应后溶液质量为221.3g。计算:
(1)参加反应的氯气的质量为 g。
(2)所用KOH溶液中溶质的质量分数是多少?
欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取30g稀硫酸样品于烧杯中,将15%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。回答下列问题:
(1)a点溶液中的溶质是 (填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)

某化学兴趣小组的同学在社会实践中,对废品回收站中废弃电器零部件黄铜(铜、锌合金)中铜的含量产生了兴趣,为了测定该黄铜中铜的含量,小组同学将黄铜带入化学实验室,称取该黄铜样品50克放入指定容器中,然后分四次加入稀硫酸,实验数据记录如表:
| 加入次数 |
第1次 |
第2次 |
第3次 |
第4次 |
| 加入稀硫酸质量(g) |
100 |
100 |
100 |
100 |
| 充分反应后剩余固体质量(g) |
43.5 |
37 |
35 |
n |
请回答下列问题:
(1)根据实验数据分析,n的数值应该为 ;
(2)黄铜样品中铜的质量分数为 ;
(3)所用稀硫酸溶质的质量分数。(写出计算过程)
小黄同学为了测定某Cu﹣Ag合金中各金属的含量,取这种合金4.8 g与AgNO3溶液反应,加入AgNO3溶液的质量m与充分反应后所得固体的质量b的关系如图所示.请计算:
(1)AgNO3溶液中溶质的质量分数(结果精确 至0.1%);
(2)该合金中银和铜的质量比(结果精确至0.1).
