向盛有28g氯化钡和氯化钠固体混合物的烧杯中加入273.3g水,固体完全溶解。再逐滴加入一定质量分数的硫酸钠溶液,反应过程中生成沉淀的质量与所加硫酸钠溶液的质量关系如图所示。(化学方程式为:Na 2SO 4+BaCl 2═2NaCl+BaSO 4↓)
请计算:
(1)固体混合物中氯化钡的质量。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
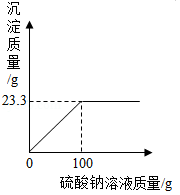
向盛有28g氯化钡和氯化钠固体混合物的烧杯中加入273.3g水,固体完全溶解。再逐滴加入一定质量分数的硫酸钠溶液,反应过程中生成沉淀的质量与所加硫酸钠溶液的质量关系如图所示。(化学方程式为:Na 2SO 4+BaCl 2═2NaCl+BaSO 4↓)
请计算:
(1)固体混合物中氯化钡的质量。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
