我国既是陆地大国,又是是海洋大国,拥有丰富的海洋资源,开发前景广阔。我们食用的食盐,大部分是从海水中得到的,我国海水“晒盐”历史悠久。
(1)盐场海水晒盐的原理是________(填序号)。
A.氯化钠的溶解度受温度影响变化较大,故采取降温结晶的方法
B.因氯化钠溶解度受温度影响变化不大,故采取蒸发水分的方法
(2)晒盐得到粗盐,主要含泥沙、氯化镁等杂质,需要提纯,主要操作流程如下: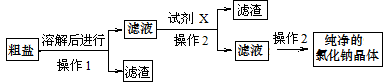
①操作1的名称是________。
②操作1过程中玻璃棒的作用是________
③试剂X是________(选择合适的序号填空)
A.NaOH溶液 B.KOH溶液 C.稀硫酸 D.稀盐酸
(3)我国化学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,制得纯碱(Na2CO3)。Na2CO3和NaCl的溶解度曲线如图所示,下列叙述中正确的是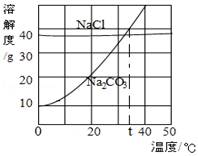
A.NaCl的溶解度大于Na2CO3的溶解度
B.t℃时,Na2CO3和NaCl的饱和溶液中溶质的质量相同
C.20℃时,100g Na2CO3饱和溶液中含有20g Na2CO3
D.当Na2CO3中含有少量的NaCl时,可用降温结晶的方法提纯Na2CO3
如图是a、b、c三种固体物质的溶解度曲线

(1)在t1℃时,a、b、c三种物质中,溶解度最大的是 ;
(2)t1℃时,将30g a物质放入100g水中,充分搅拌,所形成的溶液是 溶液(填“饱和”或“不饱和”);溶液中溶质的质量分数是 (精确到0.1%);此时若将温度由t1℃升至t2℃,还应再加入a物质 g,才能变成饱和溶液。
(3)从a、c的饱和溶液中提取a,应采用方法是 (填“冷却结晶”或“蒸发溶剂”)。
(1)下图是不与水发生化学反应的a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
①P 点的含义是 。
②t 2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是 (填写物质序号)。
③t 2℃时30ga物质加入到50g水中不断搅拌,所得溶液的溶质质量分数 。
④将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是 (填写选项序号)。
| A.c>a=b | B.a=b>c | C.a>b>c | D.b>a>c |
(2)根据下表回答:
| |
OH- |
NO3- |
Cl- |
SO42- |
CO32- |
| H+ |
|
溶、挥 |
溶、挥 |
溶 |
溶、挥 |
| Na+ |
溶 |
溶 |
溶 |
溶 |
溶 |
| Ca2+ |
微溶 |
溶 |
溶 |
微溶 |
不溶 |
| Cu2+ |
不溶 |
溶 |
溶 |
溶 |
不溶 |
| Ba2+ |
溶 |
溶 |
溶 |
不溶 |
不溶 |
| Zn2+ |
不溶 |
溶 |
溶 |
溶 |
不溶 |
①BaCO3的溶解性 。从上表中找出一种不溶碱 (填化学式)。
②Zn(NO3)2、BaCl2两种溶液能不能发生反应? (填:能”或“不能”)
③利用上表写一个有氢氧化铜生成的复分解反应化学方程式: 。
下表为两种物质在不同温度时的溶解度
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/ | 27.6 |
34.0 |
40.0 |
45.5 |
51.1 |
56.7 |
|
| 13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
请回答:
(1)60 ℃时,
的溶解度是
;
(2)40 ℃时,将30
加入到50
水中,充分溶解后所得溶液是溶液(填写"饱和"或"不饱和");
(3)将20 ℃时
和
的两种饱和溶液升温至60 ℃,则两种溶液的溶质质量分数大小关系是:
(填写">"、"<"或"=")。
我国化学家侯德榜创立的侯氏制碱法,就是以海水晒盐得到的氯化钠为原料,制得纯碱碳酸钠,碳酸钠和氯化钠的溶解度曲线如图所示,试回答下列问题: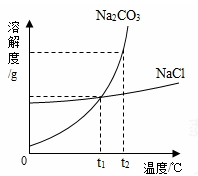
(1)t2℃时,氯化钠的溶解度 碳酸钠的溶解度。(填“大于”“小于”“等于”之一)。)
(2)我国某些盐湖出产天然碱(主要成分是纯碱,并含有少量氯化钠杂质)。在实验室里,从天然碱中分离出较纯净的纯碱晶体应采用 的方法。
(3)在实验室中,若要测定盐湖水的酸碱性强弱,可以使用 测定。
(4)氯化钠通常采取海水晒盐的方法获得,其原因是 。
(5)在侯氏制碱法中碳酸钠是由碳酸氢钠加热分解得到的,试写出你所了解的碳酸氢钠在生活中的一项用途: 。
硫酸亚铁铵晶体俗称摩尔盐,化学式为FeSO4·(NH4)2SO4·6H2O,在制药、电镀方面有广泛的应用。某化学兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
资料:①硫酸亚铁铵晶体易溶于水,不溶于酒精;硫酸亚铁铵晶体在100℃~110℃时分解。
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ |
FeSO4 |
(NH4) 2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 10 |
20.0 |
73 |
17.2 |
| 20 |
26.5 |
75.4 |
21. 6 |
| 30 |
32.9 |
78 |
28.1 |
请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍。碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH 7(选填“>”、“<”或“=”)。
(2)①中发生反应的化学方程式为 。
(3)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 。
(4)操作③中使用无水酒精洗涤,可快速晾干。这样做的优点是 (填字母)。
A.避免用水洗涤所造成的晶体损耗
B.酒精易挥发,可低温晾干晶体
人类的日常生活和工农业生产离不开水。请回答:
(1)水(填"属于"或"不属于")人类所需的六大基本营养素之一。
(2)含有较多可溶性钙、镁化合物的水叫做(填"软水"或"硬水")。
(3)下列净化水的单一操作中,相对净化程度较高的是(填字母)
| A. |
静置沉淀 |
B. |
吸附沉淀 |
C. |
蒸馏 |
(4)水在通电的条件下可以分解,写出该反应的化学方程式。
(5)甲和乙两种固体物质的溶解度曲线如下图所示,回答下列问题:

①在℃时,甲和乙两种物质的溶解度相等。
②将
℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是(填"甲"或"乙")。
③
℃时,将60
甲物质放入100
水中,充分搅拌,所得溶液的溶质质量分数
(甲)与同温下乙物质的饱和溶液的溶质质量分数
(乙)大小关系为(填字母)。
| A. |
(甲)< (乙) |
B. |
(甲)> (乙) |
C. |
(甲)= (乙) |
D. |
无法确定 |
如图是A、B两种物质的溶解度曲线,请回答:

(1)在40℃时A、B的溶解度大小关系是;
(2)a点是A、B两条曲线的交点,其含义是;
(3)20℃时将20g A固体放入50g水中,充分溶解后,所得溶液的质量是g;
(4)若A中含有少量的B杂质,提纯A的方法是结晶。
、
两种固体物质的溶解度曲线如图所示,请根据曲线图回答下列问题。
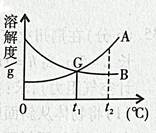
(1)现有常温下
的不饱和溶液,在只要求保持其中溶剂质量不变的条件下,将其变成饱和溶液,可行的方法有。
(2)现有一杯
时含
、
两种物质且均饱和的混合溶液,若要从中分离出少量A的纯净物,其操作方法是。
(3)下列说法正确的是。
①
时,
的溶液中溶质的质量分数一定比B的溶液中溶质的质量分数大;
② 将
,
、
的饱和溶液分别降温至
,此时两溶液中的质量分数相等;
③ 在
时,用两份等量的水分别配制成
、
的饱和溶液,这两种溶液的质量相等;
④ 在
时,用等量的
、
分别配制成两种饱和溶液,测得其质量依次为
和
,则
。
溶解度是解决溶液相关问题的重要依据.
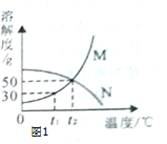
Ⅰ.根据图1解决下列问题:(
,
均不含结晶水)
(1)温度为
时,
,
两种物质的溶解度相等;
(2)
时,将20g
加入50g水中,充分溶解,形成溶液的质量为g.保持温度不变,向该溶液中再加入10g水充分搅拌,溶液的溶质质量分数将(填"变大"、"变小"或"不变");
(3)
时,将25g
加入50g水中,完全溶解后要提高该溶液的溶解质量分数,其操作方法是.
Ⅱ.根据表格解决实际问题:
| 温度/ | 20 |
30 |
50 |
80 |
90 |
|
| 溶解度/g |
|
31.6 |
45.8 |
85.5 |
100 |
169 |
|
|
110 |
114 |
121 |
126 |
139 |
某
样品中含有少量
,其提纯过程如图2: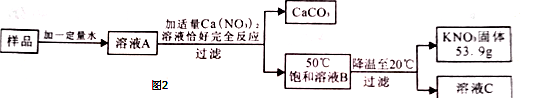
(1)图2中溶液
是(填"饱和"或"不饱和")溶液;
(2)样品中钾元素的质量为g(结果保留整数).
下图是两种物质的溶解度曲线,下列说法正确的是( )

| A. | 甲的溶解度大于乙的溶解度 |
| B. | ℃时等质量甲、乙两种物质的饱和溶液中溶质质量相等 |
| C. | ℃时等质量的甲、乙两物质的饱和溶液降温至 ℃时,两溶液中溶质质量分数相等 |
| D. | 氧气的溶解度随温度变化的规律与图中乙相似 |
海水淡化可采用膜分离技术.如图一所示,对淡化膜右侧的海水加压,在其左侧得到淡水.其原理是海水中的水分子可以透过淡化膜,而其他各种离子不能透过。
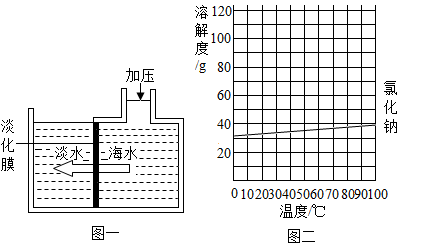
请回答:
(1)采用膜分离技术淡化海水的原理,与化学实验中常见的操作相似。
(2)对淡化膜右侧的海水加压后,海水中溶质的质量分数会(填"增大"、"减小"或"不变")。
(3)海水中含有大量的氯化钠,图二是氯化钠的溶解度曲线,据此可知盐场从海水中得到食盐晶体利用的方法是结晶(填"降温"或"蒸发")。
如图是
、
、
三种固体物质的溶解度曲线图,请回答:

(1)
、
、
三种物质的溶解度受温度影响最大的是;
(2)t1℃时
的溶解度(填">"、"<"或"=")
的溶解度;
(3)在t2℃时,将15g
物质加入到50g水中,充分搅拌后,所得溶液中溶质的质量分数为。
某化学小组初步探究"氢氧化钠溶液与盐酸发生中和反应时溶液温度的变化情况".
实验用品:37%的浓盐酸(密度为
)、10%的氢氧化钠溶液、蒸馏水、量筒、温度计
实验一:配制100
10%的盐酸(密度为
)
实验步骤
(1)计算:需要37%的浓盐酸的体积为
(精确到0.01
,下同);需要蒸馏水的体积为
(水的密度为
)
(2)量取浓盐酸和蒸馏水。
(3)混合配制。
实验二:在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸(室温下),反应中溶液温度的变化如下:

(1)表中
的值为.
(2)试绘出溶液温度变化与加入盐酸体积之间的关系图.
(3)根据所绘曲线分析,加入盐酸的体积在0~10
时,溶液温度变化的趋势及其原因是。
(4)其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线的分析,大胆猜想新曲线最高点的位置(不考虑溶液密度和比热容的变化及热量散失等影响因素)。
横坐标及猜想理由:;
纵坐标及猜想理由:。
