如图是
、
、
三种物质的溶解度曲线,请据图回答:

(1)
℃时,
、
、
三种物质的溶解度由大到小的顺序是(填序号,下同);
(2)
℃时,将100
物质加入到100
水中并充分搅拌,形成溶液的质量为
;
(3)将℃时
、
、
三种物质的饱和溶液降低温度到
℃时,这三种溶液中溶质质量分数的大小关系是.
(10内江2)20℃时,碳酸氢钠的溶解度为9.7g,其含义是在20℃时___________________;工业上用氨碱法制纯碱时,向饱和氨盐水中不断通入CO2,同时生成碳酸氢钠和氯化铵,但却只有碳酸氢钠结晶析出,原因是________________________。
右图是A/B/C三种固体物质的溶解曲线图,请根据图示回答:
(1)P点表示的意义是 。
(2)t2℃时A、B、C三种物质的溶解度由大到小的顺序为 。
(3)要将A的不饱和溶液变成饱和溶液,可采取的方法有 (填一种即可)。
下表是
在不同温度时的溶解度.
| 温度 | 0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 溶解度 | 27.6 |
31.0 |
34.0 |
37.0 |
42.6 |
45.5 |
小明为测定
的值,取4份40
的水各50
,分别进行实验,并记录数据如下表.
| 实验编号 |
实验1 |
实验2 |
实验3 |
实验4 |
| 质量 | 5 |
15 |
25 |
35 |
| 溶液质量 | 55 |
65 |
70 |
70 |
请回答下列问题.
(1)实验中需要用到的仪器有(只写一种).
(2)要使实验2的溶液达到饱和,可采取的方法是.
(3)由实验可知,40
时
的溶解度
为
.
(4)小明现要配制质量分数为30 的 溶液100 ,为达实验目的其主要操作是.
下表是
、
在不同温度下的溶解度(单位:
水)
| 温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
|
13.3 |
20.9 |
32 |
45.8 |
64 |
85.5 |
110 |
138 |
169 |
202 |
246 |
| 35.7 |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
398 |
①以上两种物质溶解度的变化受温度影响较小的是.
②30
时,KNO3的溶解度是
/100
水.
③
溶液中含有少量
时,可通过的方法提纯.
④对③析出的晶体剩余溶液描述正确的是(填写编号).
I、剩余溶液一定是
饱和溶液 II、剩余溶液一定是
不饱和溶液
III、上述方法可以将两者完全分开 IV、析出的晶体中只含有
上图为氯化钠和硝酸钾固体的溶解度曲线.认真观察该图,回答下列有关问题: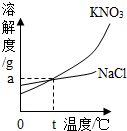
(1)根据该图可知:氯化钠的溶解度受温度影响变化不大,由该图你还获得哪些信息?(至少写出两条)
(2)若将t℃时硝酸钾饱和溶液转化为不饱和溶液,你有什么方法?
溶解度可表示物质溶解性的大小。
①图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
Ⅰ.20℃时,甲的溶解度________(填“>”、“<”或“=”)乙的溶解度。
Ⅱ.40℃时,乙和丙________(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃。请填写下表。
| 烧杯中的溶质 |
烧杯中固体的变化 |
| 甲 |
__________________ |
| 乙 |
固体逐渐减少至全部溶解 |
| 丙 |
__________________ |
②气体的溶解度也有一定的变化规律。
Ⅰ.打开可乐瓶,逸出大量气泡。由此可见,压强越小,CO2的溶解度越_________。为增大CO2的溶解度,可采用的一种方法是________。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如右图所示,图中t1对应的温度为40℃,则t2对应的温度________(填编号)。
a.大于40℃ b.小于40℃ c.无法确定
下图是甲、乙两种固体物质的溶解度曲线。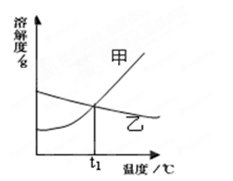
(1)在t1℃时,甲、乙两种固体物质的溶解度 (填相等或不相等);
(2)把甲物质的不饱和溶液变成饱和溶液,下列有关说法正确的是 (填字母序号);
| A.溶剂的质量一定变小 |
| B.溶质的质量一定不变 |
| C.该饱和溶液还可以溶解其他物质 |
| D.溶液的质量可能不变 |
(3)在实验室中,用固体物质甲和水配制成一定溶质质量分数的溶液,需用到的仪器有:烧杯、药匙、胶头滴管、 和 。
(1)根据钠元素在元素周期表中的信息,将下图方框内①-⑤项内容补充完整:

(2)硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:

①
时,两物质中溶解度较大的是。
②
时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是的溶液。
③
时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的(填"饱和"或"不饱和")溶液。保持温度不变,往该烧杯中再加入10g水,充分搅拌后,氯化钾溶液的溶质的质量分数(填"变大"、"不变"或"变小")。
④欲配制溶质的质量分数为20%的硝酸钾溶液,应满足的温度范围是。
(3)某同学进行下图所示实验,证明酸碱发生反应的现象为:试管中溶液由色变为无色,该反应的化学方程式。实验后测得试管中溶液的pH=2,该溶液中的溶质有(写名称)。

在实验室小金分别用甲盐的晶体配置了溶质质量分数为5%的A溶液和30%的B溶液,但忘了贴标签,请你运用两种不同的科学原理,分别设计两个简单实验来判别这两瓶溶液。请写出简要的实验方案和明确的判别依据。有下列仪器、物品供选择:量筒、天平、
小烧杯、酒精灯、三脚架、石棉网、漏斗、玻璃棒、滤纸、温度计、新鲜罗卜、甲盐的晶体。
(实验室的室温为30℃,30℃甲盐的溶解度为50g)
方案1:
判别依据:
方案2:
判别依据:
下列是MgSO 4和KCl的溶解度表及溶解度曲线。
| 温度/℃ |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|
| 溶解度/g |
MgSO 4 |
33.7 |
38.9 |
44.5 |
50.6 |
54.6 |
55.8 |
52.9 |
52.2 |
| KCl |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
51.1 |
54.0 |
|
请分析后回答下列问题:
(1)代表KCl溶解度曲线的是 (填"甲"或"乙")。
(2)t 2的范围为 (填字母)。
| A. |
50~60 |
| B. |
60~70 |
| C. |
70~80 |
| D. |
80~90 |
(3)将t 3℃时MgSO 4的饱和溶液降温到t 1℃,溶液中溶质的质量分数的变化情况是 (填字母)。
| A. |
始终不变 |
| B. |
先增大后减小 |
| C. |
先减小后增大 |
| D. |
先不变后减小 |
| E. |
先不变后增大 |

根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
溶解度/g |
80.8 |
87.6 |
94.9 |
103 |
113 |
124 |
136 |
149 |
(1)20℃时,将90g NaNO3固体加入盛有100g水的烧杯中,充分搅拌后,得到溶液的质量为 g。给烧杯加热,使溶液温度升至40℃时,溶液中溶质与溶剂的质量比为 。
(2)80℃时,将249g NaNO3饱和溶液降温至 时,溶液质量变为224g。
(3)50℃时,将200g溶质质量分数为50%的NaNO3溶液改为该温度下的饱和溶液,至少应向溶液中再加入 g NaNO3固体。
K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图:
温度/℃ |
20 |
30 |
50 |
60 |
80 |
|
溶解度/g |
K2CO3 |
110 |
114 |
121 |
126 |
139 |
KNO3 |
31.6 |
45.8 |
85.5 |
110 |
169 |
|
(1)图1中能表示K2CO3溶解度曲线的是 (填“甲”或“乙”)。
(2)在20℃时,将20g的KNO3加入到50g的水中,充分搅拌,得到溶液的质量为 g。
(3)在t℃时,K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1 w2(填“>”、“=”或“<”)。
(4)在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和溶液的方法是: 。

如图为甲、乙、丙三种固体物质的溶解度曲线,据图回答下列问题:
(1)由图可知在t 2℃时,甲物质的溶解度为 g。
(2)在t 1℃时,甲、乙、丙三种物质的溶解度从大到小的顺序是 (用"<"、"="或">"连接)。
(3)现有t 2℃时甲、乙、丙三种物质的饱和溶液,将其均降温到t 1℃,对所得溶液下列描述正确的是 (填序号)。
| A. |
溶质质量分数:乙>甲=丙 |
| B. |
溶液质量:丙>乙>甲 |
| C. |
溶剂质量:无法确定 |
