(1)用化学符号表示:①硫酸铁;②3个二氧化碳分子;③2个氢离子.
(2)下图是
三种不含结晶水物质的溶解度曲线,回答下列问题:

①在
,
的溶解度相等;
②随温度的升高,其中溶解度反而减少的是(选填
);
③在 时,三只烧杯中个装入等质量的水,分别溶解 三种物质使其达到饱和溶液,其中溶解最多的物质是(选填 ).
KCl与KNO3在不同温度的溶解度数据如右表。则下列说法正确的是
| A.KNO3比KCl的溶解度大 |
| B.两物质的溶解度相等的温度在20-30℃间 |
| C.在20℃时,10g水中加入5gKCl可得到33.3% 的KCl溶液 |
| D.在50℃时,两物质各5g分别加入l0g水中, 充分溶解,均有固体剩余 |
如图是甲、乙、丙三种固体物质的溶解度曲线.下列有关说法错误的是( )

| A. | 丙物质的溶解度随温度的升高而降低 |
| B. | 时三种物质的饱和溶液,乙的溶质质量分数最大 |
| C. | P点表示 时甲、乙两物质的溶解度相等,均为50% |
| D. | 保持溶质质量分数不变的情况下,使处于Q点的甲溶液达到饱和状态应采取降温的方法 |
下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答
(1)60℃时,氯化钠的溶解度为 g。
(2)在30℃时,100g水中加入50g硝酸钾,充分搅拌后得到的溶液质量为 g。
(3)欲从海水中获得氯化钠晶体,应采取 方法。
(4)由表中数据分析可知,硝酸钾和氯化钠在某一温度时具有相同的溶解度x,则x的取值范围是 g。
关于溶液,下列说法错误的是( )
| A.固体、液体、气体都可以作为溶质 |
| B.硝酸铵溶于水的过程中,溶液温度下降 |
| C.75%的医用酒精中,C2H3OH与H2O的质量比为3:1 |
| D.在25℃时,KNO3溶液蒸发5g水,析出ag晶体,再蒸发5g水,又析出bg晶体,则a与b的质量不一定相等 |
现有一接近饱和的Ca(OH)2溶液①蒸发溶剂,②增加溶质,③降低温度,④加热升温,这些方法中能使之成为饱和溶液的是
| A.只有①② | B.只有②③ | C.①②③ | D.①②④ |
甲、乙两物质的溶解度曲线如图所示,下列说法不正确的是( )

| A. | 时,甲和乙的溶解度相等 |
| B. | 甲和乙的溶解度都随温度的升高而增大 |
| C. | 时,甲和乙各30g分别加入90g水中,均能完全溶解 |
| D. | 时,在100g水中放入60g甲,形成饱和溶液 |
将60℃时的硝酸钠饱和溶液冷却到20℃,下列说法正确的是
| A.溶液的溶质质量分数不变 | B.溶液变成不饱和溶液 |
| C.溶液质量增加 | D.溶液中溶质的溶解度减少 |
甲乙两种固体的溶解度曲线如下图所示。有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在。现将温度由80℃降到20℃。下列说法错误的是
| A.杯中固体甲增多、固体乙减少 |
| B.杯中一定有固体甲而不一定有固体乙 |
| C.溶液中溶质甲减少、溶质乙增多 |
| D.甲和乙的两种溶液仍然是饱和溶液 |
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题:
(1)t1℃时,甲物质的溶解度 (填“>”“<”或“=”)丙物质的溶解度;
(2)将丙的不饱和溶液变为饱和溶液的方法是 ;
(3)t2℃时,将一定质量的甲物质加入到100g水中完全溶解,再降温到t1℃,析出甲物质15g,则t2℃时,加入甲物质的质量为 g;
(4)将t3℃时甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为 。

溶液与人类的生活息息相关。
(1)下列少量物质分别放入水中,充分搅拌,能得到溶液的是 (填序号)。
A.面粉
B.硝酸钾
C.泥沙
D.花生油
(2)下表是氯化钠和氯化钾在不同温度时的溶解度。
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
溶解度 |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
KCl |
27.6 |
34.0 |
40.0 |
45.5 |
51.1 |
|
①20℃时,氯化钠的溶解度为 g。
②20℃时,将20g氯化钠固体加入到50g水中,充分溶解,所得氯化钠溶液的质量为
g。
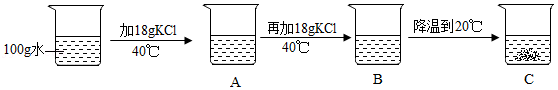
③某同学进行实验如图所示,得到相应的A、B、C三种溶液,C中析出的氯化钾固体质量为 g。
打开啤酒瓶盖时,你会发现啤酒会自动喷出,喝了啤酒后又常常会打嗝,这说明气体溶解性与外界的压强和温度有关,下列关于气体溶解度说法不正确的是
| A.压强减少,气体溶解度增大 | B.压强减小,气体溶解度减小 |
| C.温度升高,气体溶解度减小 | D.温度降低,气体溶解度增大 |
20℃时,在两只各盛有50克水的烧杯中,分别加入30克氯化钠和蔗糖固体,搅拌使其充分溶解,结果如图所示。下列说法正确的是()

| A. | 两烧杯中的溶液质量相等 | B. | 20℃时两者的溶解度相等 |
| C. | 氯化钠溶液一定是饱和溶液 | D. | 蔗糖溶液一定是饱和溶液 |
下图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线。现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在)。下列说法正确的是
| A.三种物质溶解度大小依次为:乙>丙>甲 |
| B.将温度由t2℃降到t1℃时,析出甲的质量比乙多 |
| C.若甲中含有少量杂质乙,可采用降温结晶的方法进行提纯 |
| D.将温度由t2℃降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>丙=甲 |
下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/g |
Ca(OH)2 |
0.19 |
0.17 |
0.14[ |
0.12[ |
0.09 |
0.08 |
| NaOH |
31 |
91 |
111 |
129 |
313 |
336 |
|
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是 (填A或B)。

(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。
其中措施正确的是 。
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为 。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙 甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是 。
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH (填“偏大”、“偏小”或“不受影响”)。