小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
| 序号 |
温度/℃ |
水的质量/克 |
加入硝酸钾的质量/克 |
所得溶液的质量/克 |
| ① |
10 |
100 |
40 |
120.9 |
| ② |
60 |
100 |
40 |
140 |
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
a、b、c三种固体物质的溶解度曲线如图所示。下列说法正确的是( )

| A. |
t 1℃时,a物质的溶解度是30g |
| B. |
t 2℃时,b的饱和溶液中溶质的质量分数为50% |
| C. |
t 3℃时,各取15g a、b、c三种物质分别加入到50g水中充分溶解,能得到饱和溶液的是c |
| D. |
t 2℃和t 3℃时的两份b溶液,所含溶质的质量不可能相等 |
如图是甲、乙、丙三种固体的溶解度曲线图。据图回答下列问题:
(1)乙、丙两物质在 ℃时溶解度相等。
(2)将t2℃时甲的饱和溶液变为不饱和溶液,在保证溶液质量不改变的前提下可采取的方法是 。
(3)t2℃时欲配制50g 15%的乙物质的溶液,需量取水 mL.(水的密度为1g•cm﹣3)
(4)t3℃时,将三种物质各ag分别加入100g水中,充分溶解后,只有一种物质形成不饱和溶液,则a的取值范围是 。

设计实验、动手操作、观察现象、记录信息、提炼证据、进行推理、形成结论是化学学习的重要方法。
(1)学习化学概念“饱和溶液”﹣﹣﹣实验“KNO3溶于水”
[实验用品]KNO3(研磨处理)、水、玻璃棒、三脚架、石棉网、酒精灯、烧杯等。
[实驰探究]在室温20℃下。向小烧杯中加入20mL水,按下表中设计的操作步骤进行实验。
实验序号 |
实验步骤 |
实验现象 |
实验推理 |
实验结论 |
Ⅰ |
加入2g KNO3,搅拌 |
全部溶解 |
不一定形成饱和溶液 |
在一定温度下,一定量水中不能无限制地溶解溶质 |
Ⅱ |
再加入5g KNO3,搅拌 |
部分溶解 |
|
|
Ⅲ |
加热,搅拌 |
解 |
不一定形成饱和溶液 |
KNO3的溶解度随温度的升高而 。 |
Ⅳ |
再加入5g KNO3,搅拌 |
全部溶解 |
不一定形成饱和溶液 |
|
Ⅴ |
放在冷水的大烧杯中冷却 |
析出晶体 |
一定形成饱和溶液 |
KNO3可用 的方法结晶 增加溶剂的质量,可将饱和溶液转化为不饱和溶液 |
Ⅵ |
,搅拌 |
全部溶解 |
一定形成不饱和溶液 |
[实验反思]
①KNO3预先研磨处理的目的是 。
②实验步骤 (填实验序号,下同)中KNO3的溶质质量分数最大。
③比较实验步骤 中观察到的实验现象,经分析推理。可得出将KNO3饱和溶液转化为不饱和溶液的另一种方法,即升高饱和溶液的温度。
(2)应用化学知识“身边的化学”﹣﹣﹣体验“家庭燃料的变迁”
[文献资料]
①天然气和煤都是 (选填“可再生”或“不可再生”)能源;天然气的主要成分是 (填化学式)。
②我国近50年来家庭燃料变迁:煤或木柴→液化石油气或管道煤气→天然气。
③CO2能产生 效应,SO2易导致酸雨。
④充分燃烧天然气和煤各lkg产生CO2和SO2的质量如图所示。
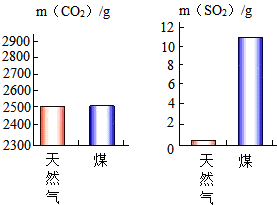
[证据推理]各级政府推广“利用天然气代替煤作家庭燃料,分析文献资料可知实施该项举措的科学依据是 。
[联系实际]为防止燃气泄漏造成危险,使用天然气的家庭“将报警器安装位置确定在燃气灶附近墙壁的上方”,这是基于天然气具有 的性质。
[反思拓展]保护生态环境是建设“人类命运共同体”的重要组成部分,我国科学家正在利用和开发H2等新能源,在一定程度上减少对环境的污染。请再列举一例可利用的新能源: 。
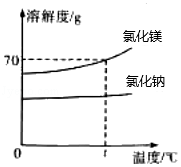
大连复州湾盐场是我国四大海盐场之一,利用传统的海水晒盐工艺,可得到氯化钠和氯化镁等物质。如图是氯化钠和氯化镁的溶解度曲线。
(1)两种物质中, 的溶解度受温度的影响较大。
(2)t℃时,氯化镁饱和溶液中溶质与溶剂的质量比为 。
(3)将接近饱和的氯化钠溶液变为饱和溶液,可采用的一种方法是 。
(4)海水晒盐是利用 的方法获得晶体。
如图是硼酸的溶解度曲线,下列说法正确的是( )

| A. |
a点的硼酸溶液中溶质的质量分数为10% |
| B. |
将a点的硼酸溶液升温至t 2℃时,仍是饱和溶液 |
| C. |
将b点的硼酸溶液降温至t 1℃时,有晶体析出 |
| D. |
t 2℃时,向50g水中加入20g硼酸后充分搅拌,可得70g溶液 |
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答。
(1)t3℃时,甲的溶解度为 g。
(2)将丙的饱和溶液变为不饱和溶液的一种方法是 。
(3)t1℃时,甲、乙的饱和溶液各100g,分别蒸发掉10g水,析出固体的质量:甲 (填“>”“<”或“=”)乙。
(4)t2℃时,在各盛有甲、乙、丙25g固体的三个烧杯中,分别加入100g水,充分搅拌后,能形成饱和溶液的是 ;将三个烧杯中的物质均升温至t3℃,此时,溶液中溶质的质量分数的大小关系为 。

科学发现往往源于对实验现象的观察与研究。
(1)如图甲进行白糖溶解实验,根据图中现象判断:溶液② (填“是”“不是”或“可能是”)白糖的饱和溶液。

(2)如图乙所示,小科利用集气瓶收集从导管导出的氧气时,每隔一段时间,他就取出导管,再用带火星的木条放在瓶口验满。可是他始终没有观察到带火星木条复燃,小科实验操作中出现的错误是 。
X、Y、Z三种物质的溶解度曲线如图所示,下列说法正确的是( )

A.Y的溶解度为50g
B.T2℃时,X、Y两种物质溶解度相等
C.T1℃时,三种物质的溶解度由大到小的顺序是Y>X>Z
D.T2℃时,50g H2O与50g X混合,可得到100g X的饱和溶液
如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )

A.在t2℃时,甲、乙两物质的溶解度相等
B.在t1℃时,甲、乙、丙三种物质的饱和溶液中,溶质甲的质量最大
C.甲中混有少量乙时,宜采用降温结晶的方法提纯甲
D.将t3℃的甲、乙、丙三种物质的饱和溶液降温至t1℃时,只有丙溶液仍是饱和溶液
如图是KNO3和NH4Cl的溶解度曲线,下列叙述错误的是( )
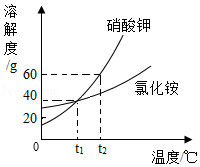
A.t1℃时,KNO3的溶解度与NH4Cl的溶解度相等
B.t2℃时,KNO3饱和溶液中溶质的质量分数是37.5%
C.t1℃时,NH4Cl的不饱和溶液降温,肯定无晶体析出
D.t2℃时,KNO3饱和溶液中溶质的质量分数大于NH4Cl饱和溶液中溶质的质量分数
硝酸钾的溶解度曲线如图所示。回答下列问题:
(1)30℃时,硝酸钾的溶解度是 g。
(2)60℃时,在100g水中加入60g硝酸钾固体,充分搅拌,所得溶液是 (填"饱和"或"不饱和")溶液。
(3)将(2)中所得的溶液从60℃降温至30℃,可析出硝酸钾晶体 g,此时溶液的溶质质量分数 45.8%(填">""<"或"=")。

如图,室温下,盛水的烧杯内放置两支分别盛有等质量KNO 3溶液和饱和石灰水的试管甲和乙,向烧杯内的水中加入NH 4NO 3固体后,甲中未观察到明显现象。下列说法正确的是( )

| A. |
乙中溶液一定变浑浊 |
| B. |
甲中溶液一定变成饱和溶液 |
| C. |
乙中溶液溶质的质量分数一定变小 |
| D. |
甲、乙中溶液质量一定相等 |
氯化钠是生产、生活中的一种重要化合物,应用很广泛。
Ⅰ.图甲和图乙分别是钠原子和氯原子的原子结构示意图。

(1)图甲中的x= 。
(2)金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的1个电子,从而形成最外层有 个电子的相对稳定的氯离子,氯离子用化学符号表示为 。
Ⅱ.如表是氯化钠在不同温度下的溶解度数据。
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
(1)30℃时,将10g氯化钠加入到50g水中,充分搅拌后,所得到的氯化钠溶液属于
(填“饱和”或“不饱和”)溶液。
(2)医用盐水(溶质为NaCl)的溶质质量分数为0.9%,现有200mL该盐水(假定该溶液的密度为1g/mL),其中含NaCl的质量为 g。
(3)学生化学实验活动之一:配制50g质量分数为6%的氯化钠溶液,该实验需要的仪器有药匙、托盘天平、玻璃棒、胶头滴管、 (从下列图中选择写出名称)。

Ⅲ.工业上常用电解饱和食盐水的方法来制取氢氧化钠、氯气和氢气,其化学反应方程式可表示为:xNaCl+yH2O zNaOH+wH2+vCl2↑,若w=v=1,那么x=y=z=
zNaOH+wH2+vCl2↑,若w=v=1,那么x=y=z=
(填数字)。
NaHCO3在生产和生活中有许多重要用途,某学习小组对其性质进行了如下探究。物质的溶解度见下表。回答下列问题:
温度 |
10℃ |
20℃ |
NaHCO3的溶解度(g/100g水) |
8.1 |
9.6 |
Ca(HCO3)2的溶解度(g/100g水) |
16.6 |
(1)在20℃时称取4g NaHCO3加入46mL蒸馏水(密度取值为1g/mL),充分搅拌制得澄清溶液。该实验可以达到探究NaHCO3 性的目的;实验中不需要的仪器是 (选填字母编号)。

(2)用pH计测得溶液的pH为8.2,说明溶液呈 性。
(3)所配NaHCO3溶液的质量分数等于 ,降温到10℃时溶液 (填“是”或“不是”)饱和溶液。
(4)取2mL所配NaHCO3溶液于试管中,滴加5%的CaCl2溶液,观察到气泡和白色沉淀,实验证明该气体是CO2.据此小组同学讨论认为:白色沉淀不可能是Ca(OH)2,其理由是 ,于是得出结论:白色沉淀是 。