五氧化二钒(V 2O 5)是一种工业催化剂,如图是制取V 2O 5的工艺流程。
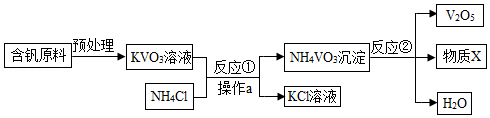
(1)写出反应①的化学方程式 。
(2)操作a的名称是 ,实验室进行该操作所需的玻璃仪器有烧杯、玻璃棒和 。
(3)反应②的反应类型是 ,物质X中一定含有的元素是 。
(4)写出副产物KCl的一种用途 。
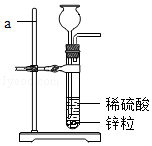
实验室常用如图所示发生装置制备氢气。
(1)写出试管中反应的化学方程式 。
(2)仪器a的名称是 ,实验室可用 方法收集氢气。
(3)氢气作为新能源的优点是 (写出1点即可,下同),目前氢能源的大量使用仍存在一定困难,你认为针对氢能源的研究方向是 。
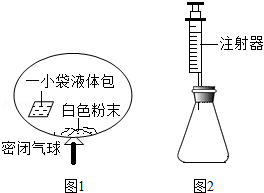
某研究小组对自动充气气球(示意图如图1)进行下列探究.
【查阅资料】该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用 (填试剂名称).
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈 性.
探究二:白色粉末成分的探究
【猜想与假设】甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
【设计并进行实验】
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想 (填"正确"或"不正确").
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
| 实验编号 |
锥形瓶内物质 |
最终得到CO 2体积/mL |
|
| 名称 |
质量/g |
||
| ① |
碳酸氢钠 |
0.10 |
V 1 |
| ② |
碳酸钠 |
0.10 |
V 2 |
| ③ |
白色粉末 |
a |
V 1 |
实验①的化学方程式为 ;表中a= ;V 1 V 2(填">"、"<"或"=").
【分析并得出结论】
(5)如何从上表中获取证据并得出结论? .
高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌。
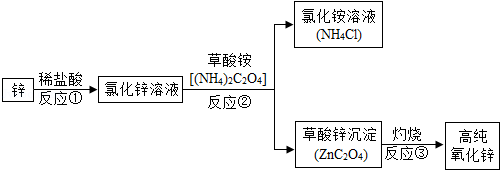
(1)反应①的化学方程式为 。
(2)反应②的基本反应类型是 。
(3)反应②后进行的分离操作名称是 ,若得到的NH4Cl溶液有浑浊,原因可能是 (写出一种即可) 。
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为 、 。
甲烷是一种无色、无味、密度比空气小,难溶于水的气体.请阅读有关甲烷材料,完成下列各题:
(1)今年5月18日新闻联播报道:我国在南海成功完成了“可燃冰”试验开采工作.可燃冰主要成分是甲烷,学名叫“天然气水合物”,是一种高效清洁、储量巨大的新能源.甲烷作为燃料是因为它具有 性.
(2)一定条件下,氢气与溶解在水中的二氧化碳结合生成甲烷和水,这一化学反应被称作“产甲烷作用”.请写出“产甲烷作用”的化学方程式: .
(3)实验室用加热无水醋酸钠与碱石灰固体混合物来制取并收集一瓶较为纯净的甲烷气体,则应选用图中的 装置(填字母)

图甲为制取和收集二氧化碳的家庭实验装置,左边部分带小孔的眼药水瓶,下部可浸入和离开白醋,以控制反应进行与停止,它相当于乙图中的 (选填字母)装置,该装置虚线框中应选用乙图中的 (选填字母)装置来收集CO 2气体;检验CO 2气体是否集满的方法是 。

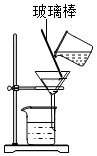
以粗盐(含杂质Na2SO4、MgCl2、CaCl2、泥沙)为原料制备精盐。
(1)加水溶解后,用如图装置除去粗盐中的泥沙,玻璃棒的作用是 。
(2)为除去Na2SO4、MgCl2、CaCl2,并得到中性的食盐溶液,下列所加试剂和操作:①加过量的Na2CO3溶液,②过滤,③加过量的NaOH溶液,④加适量的稀HCl,⑤加过量的BaCl2溶液,能达到目的顺序是 。
A.⑤③②①④B.③⑤①④②C.③⑤①②④
(3)用pH试纸检验溶液是否呈中性的操作是 。
请结合图1回答问题:
(1)仪器名称:① ,② 。
(2)用氯酸钾和二氧化锰制取氧气,可选用装置 (选填序号)和D组合,反应的化学方程式为 ,二氧化锰的作用是 。
(3)实验室可用装置B或C制H 2,C装置相对于B的优点有 。用E装置收集H 2,气体应从 (选填"a"或"b")端通入。
(4)有同学将实验室制得的CO 2通入澄清石灰水,石灰水未变浑浊,于是作如图2探究:
①实验室制CO 2反应的化学方程式 。
②装置F、H中溶液变浑浊,G中溶液不变浑浊,则原石灰水未变浑浊的原因是 。
③装置G的作用是 。

如图为实验室常见的气体制备、收集等装置,按要求填空.

(1)写出A图中标号①仪器的名称 ;
(2)实验室制取二氧化碳的化学方程式为 ,用D装置验证二氧化碳能与水反应生成一种酸性物质,D中应盛放 试液(填物质名称);
(3)实验室常用块状硫化亚铁固体和稀硫酸在常温下反应制取硫化氢,硫化氢(H2S)是一种有毒气体,密度比空气大,能溶于水形成氢硫酸,实验室中常用NaOH溶液来吸收有毒的硫化氢气体,若要制取并收集一瓶硫化氢气体,选择的装置中导管的连接顺序为 (填写导管口标注的字母符号)
同学们利用如图所示装置进行气体的制备实验(A~F为装置编号)。

(1)写出图D装置中甲仪器的名称 。
(2)用A装置加热氯酸钾和二氧化锰的混合物制取氧气,化学方程式为 ,其中二氧化锰起 作用;收集氧气可以选择 (填装置编号)。
(3)实验室制取CO2通常选择下列药品中的 (填药品序号)。
a、稀盐酸 b.熟石灰 c.块状石灰石 d.稀硫酸
通常检验CO2气体的反应可用化学方程式表示为 。
(4)常温下,可用固体硫化亚铁(FeS)和稀硫酸反应制取硫化氢(H2S)气体,若要控制滴加液体的速率,可选择的发生装置是 (填装置编号,下同)。实验室制取氢气应选择的发生和收集装置的组合可以使 。
(5)制取气体前应先检查装置的气密性,若按F图所示操作,结果在导管口未看到气泡,其可能原因与下列因素无关的是 (填序号)。
a.将烧杯换成水槽 b.导管深入水中位置过深,气体无法逸出
c.将水换成冰水 d.先用手捂住试管壁,再将导管另一端插入水中。
“配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一。请回答下列问题:
(1)现欲配制一瓶500g溶质质量分数为0.9%的生理盐水,需氯化钠固体 g.下列实验操作与目的分析均正确的一组是 (填序号)。
项目 |
实验操作 |
目的分析 |
A |
称量时,将取出的过量氯化钠放回原瓶 |
节约药品 |
B |
溶解氯化钠时用玻璃棒搅拌 |
增大氯化钠的溶解度 |
C |
称取氯化钠时,在天平两边托盘上各放一张质量相等的纸 |
整洁美观 |
D |
最取所需水量时,视线与量筒内液体凹液面的最低处保持水平 |
准确读数 |
(2)实验室若用15%的氯化钠溶液加水稀释成5%的氯化钠溶液,此时需要用到的玻璃仪器有:烧杯、玻璃棒、量筒和 。
(3)实验室若用恒温蒸发的方法将15%的氯化钠溶液变成饱和溶液,其过程如图所示。与丙烧杯中溶液溶质质量分数一定相同的是 烧杯中的溶液(填序号)。

结合水和溶液的相关知识,回答下列问题:
(1)对于沉淀、过滤、吸附、蒸馏等净化水的操作,相对净化程度较高的是 。
(2)水是化学实验中常用的试剂,下列各组物质能用水鉴别的是 (填字母)。
A.氢氧化钠和硝酸铵 B.食盐和蔗糖 C.高锰酸钾和碘
(3)欲配制100g溶质质量分数为10%的氯化钠溶液,完成此实验的正确操作顺序是 。
①溶解 ②把配好的溶液装入细口瓶 ③称量 ④计算 ⑤量取
(4)如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:
①P点的含义是 。
②在t 2℃时,向30克a物质中加入50克水,充分溶解后所得溶液的质量是 克。
③将t 1℃时a、b、c三种物质的饱和溶液升温至t 2℃,所得溶液中溶质质量分数大小关系是 。
④a物质中含有少量c物质,可用 方法提纯a物质(填"降温结晶"或"蒸发结晶")。

经过一年的化学学习,你掌握了很多的化学知识和方法,请回答下列问题:
(1)湿衣服晾干,从微观角度分析是因为水分子 的结果。
(2)病人在手术后,为了促进伤口的愈合,从营养角度分析,应增加 的摄入量。
(3)我国生态环境部的最新数据显示:2018 年首批实施新《环境空气质量标准》的74个城市,
PM2.5平均浓度下降42%,SO2平均浓度下降 68%.空气中SO2的含量显著降低可减少 造成的危害。如图是硫原子的结构示意图,其中 x= 。
(4)蓝莓中的花青素可以促进视网膜细胞中的视紫质再生,预防近视,增进视力。种植蓝莓要求土壤的pH值为4.0~5.5,最适pH值为4.0~4.8.为了解家乡的土壤是否适合种植蓝莓。小张同学提取了本村土壤样品的浸出液。他的下一步操作是用 测出土壤浸出液的pH值。
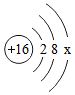
汽车尾气在装有催化剂的净化器中反应的微观过程可用如图表示
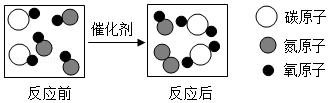
(1)①反应中没有发生改变的粒子是 (填“分子”、“原子”或“离子”)。
②写出上述反应的化学方程式 。
(2)煤燃烧时排放出的 、二氧化氮等污染物是形成酸雨的主要气体,可用 来测定雨水的酸碱度。
“绿水青山就是金山银山”。废旧干电池中有锌皮、铜帽(含金属Cu和Zn)、石墨、MnO2、NH4Cl等,若将生活中废旧干电池随意丢弃会造成水和土壤污染,因此将废旧干电池进行回收利用尤为重要。如图是回收废旧干电池成分的主要流程图(部分物质已略去)。

已知:2Cu+O2+2H2SO4═2CuSO4+2H2O.回答下列问题:
(1)从设备1中回收得到的非金属单质是 (填物质名称)。
(2)取少量回收得到的NH4Cl溶液于试管中,滴加硝酸酸化的硝酸银溶液,现象是 。
(3)流程中B溶液的溶质有H2SO4、 和 。
(4)写出设备Ⅲ中发生反应的化学方程式 。