下图是某同学完成《实验活动5 一定质量分数的氯化钠溶液的配制》中“配制
50 g质量分数为6%的氯化钠溶液”的全过程。
(1)图中的错误有:
① ;
② 。
(2)若所配制的盐水中NaCl 的质量分数小于6%,则可能造成误差的原因有(至少举
出两点)。
① ;
② 。
(3)由浓溶液配制稀溶液时,计算的依据是 。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是 。在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、冷却至室温装瓶并贴上标签。
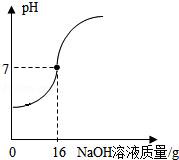
(4)取某稀硫酸样品10g,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌。溶液pH的变化如图所示。试回答:
①a点溶液中含有的离子有 。
②当pH=7时,消耗NaOH溶液中NaOH的质量为 g。
③计算稀硫酸的溶质质量分数。(写出计算过程)
国家标准规定工业纯碱中碳酸钠的质量分数≥98.0%为合格品。为测定某工业纯碱是否为合格品,兴趣小组成员分别进行了如图的实验。(杂质不参与反应,过滤后滤渣损失忽略不计)

(1)溶解时玻璃棒的作用是 。
(2)实验中加入过量CaCl2溶液的目的是 。
(3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确到0.1%)
(4)实验过程中个别同学出现了以下问题。
①过滤时得到的滤液浑浊,原因可能是 ;(任写一种)
②过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该样品中碳酸钠的质量分数计算结果 。(选填“偏大”、“不变”或“偏小”)
请根据下图所示的实验过程和提供的数据,试回答下列问题:
(1)在第②步实验操作中,观察到的一项实验现象是: 。
(2)第①步实验操作后,烧杯中溶液里含有的溶质是(写化学式) 。
(3)计算原混合物样品中CaCl2的质量(写出计算过程,结果精确至0.1g)。
工业生产常用"苛化法"制取氢氧化钠。其原料为碳酸钠、石灰乳[由Ca(OH) 2和水组成的混合物],大致流程如图1。

科学兴趣小组模拟上述流程,在实验室中制备氢氧化钠。
(1)实验室进行"操作1"时,需要用到下列器材(图2)中的 (可多选)。
(2)制备氢氧化钠的化学方程式为,Na 2CO 3+Ca(OH) 2=2NaOH+CaCO 3↓.将53克溶质质量分数为20%的碳酸钠溶液与17克石灰乳混合,若二者恰好完全反应出计算所得氢氧化钠溶液的溶质质量分数。(写出计算过程,计算结果精确到0.1%)

(6分)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示。回答下列问题:
(1)从图中看出生成沉淀的最大质量是 g;
(2)开始加入碳酸钠溶液至10g时,还没有沉淀析出的原因是 ;
(3)加入碳酸钠溶液至40g时,溶液中的溶质是 ;
(4)计算原滤液中氯化钙的质量分数。
下图A、B、C是实验室制备某些常见气体的发生装置示意图。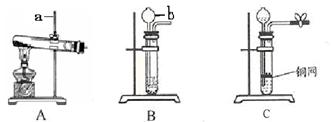
(1)写出图中标号仪器的名称:
a , b 。
(2)A可用作实验室制取氧气的化学方程式是 。
(3)B可用作实验室制取二氧化碳的化学方程式是 。
(4)下列装置可用来进行“排空气法”收集H2的是 (填序号)。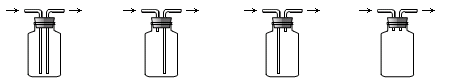
A. B. C. D.
(5)某同学在装置B的基础上,增加了隔离铜网和止水夹等改成装置C来制取二氧化碳,装置C与B相比,突出优点是 。
(6)取石灰石与稀盐酸充分反应后的溶液A, 向其逐滴加入碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如下(pH为纵坐标,时间为横坐标)。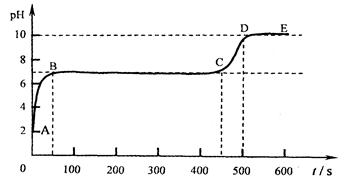
①写出BC段相关的化学方程式是 。
②CD段上升的原因是 。
③小红取溶液A50 g,逐滴加入某质量分数的碳酸钠溶液。他根据实验测得的数据绘出下图,其中纵坐标m是实验得到的沉淀的质量,横坐标表示的是碳酸钠溶液质量。由图像回答下列问题: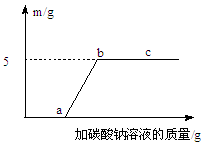
(Ⅰ)原废液中含氯化钙的质量为 g。
(Ⅱ)C点时的溶液中溶质含 。(填化学式)
某课外小组的同学用10% 的氢氧化钠溶液逐滴加入到50克稀盐酸中,边加热边搅拌,随着氢氧化钠溶液的不断加入,溶液的pH变化情况如图所示。
(1)计算当pH=7时,所得溶液的溶质质量分数。
(2)若将pH=7时所得溶液的溶质质量分数增大一倍,可采用的一种方法是 ,写出计算过程(最后结果精确到0.1)
同学们已经学习了氧气和二氧化碳的实验室制法,请你参与总结与分析: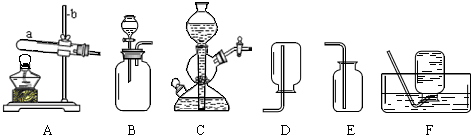
【仪器认识】装置A中仪器的名称:a (1) ,b (2) ;装置C的名称: (3)
【反应原理】用双氧水和二氧化锰混合制取氧气的化学方程式为 (4) ;
用大理石和稀盐酸制取二氧化碳的化学方程式为 (5) 。
【制取装置】用氯酸钾与二氧化锰制取氧气,可选用的发生装置是 (6) ,若收集较纯净的氧气最好选用 (7) 装置,收满的现象是 (8) 。
实验室制取二氧化碳气体,可选用的装置组合是 (9) 或 (10) ,
检验二氧化碳是否收满的方法是 (11) (简述实验操作、现象、结论)。
比较B、C装置,C装置在制取气体时,明显的优点是 (12) 。
【数据分析】实验小组用氯酸钾和二氧化锰的混合物制取氧气,反应过程中混合物的质量变化如图所示。完全反应后最终收集到0.3 mol氧气。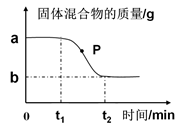
①请根据化学方程式列式计算原混合物中含氯酸钾的质量。(13)
②图中P点处试管内的固体物质有 (14)
下图所示为实验室中常见的气体制备和收集装置。
请回答下列问题:
(1)实验室用高锰酸钾制取氧气,应选用发生装置 (填字母序号),反应的化学方程式为 。若用装置D收集氧气,验满的方法是 。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,你认为选用C的优点是 。
(3)欲使用装置E用排空气法收集二氧化碳,则气体应从 (填“a”或“b”)端通入;欲使用装置E用排水法收集氧气,先将瓶中装满水,再将气体从 (填“a”或“b”)端通入。
(4)已知一氧化氮气体难溶于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中
装置 (填字母序号)。
(5)在实验室里加热30g氯酸钾(KClO3)和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为20.4g。请计算:
①生成氧气的质量为 g;
②原混合物中氯酸钾的质量。
孔雀石的主要成分是Cu2(OH)2CO3,还含有Fe2O3、Al2O3、SiO2杂质,用该矿石制备Cu的流程如图所示(部分产物略去):
 (1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(2)过程①中硫酸略过量,则过程②调pH除杂的最佳试剂是 (选填“CuO”或“Na2CO3”)。
(3)下列关于制取铜的两种方案的说法,正确的是 。
A.“方案一”得到的铜产品更纯
B.“方案一”不存在消耗能量的问题
C.“方案二”需考虑废气污染的问题
D.“方案二”得到纯铜的产率更高
(4)过程③发生的反应:2CuSO4+2H2O 2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
配制500mL的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3)。请计算:
(1)得到氢氧化钠溶液的质量为 g。
(2)需要氢氧化钠的质量为 g。
(3)需要水的质量为 g。
如图所示是某中学化学兴趣小组对二氧化碳与氢氧化钠溶液反应进行的创新实验.
已知:20℃时,氢氧化钠在乙醇中的溶解度为17.3g,而碳酸钠在乙醇中几乎不溶解.
请回答下列问题:
(1)写出仪器a的名称 .
(2)按图组装好二氧化碳的发生装置,实验前要检查装置的 .
(3)反应装置中长颈漏斗的作用是 (填序号)
A.添加稀盐酸 B.添加石灰水 C.添加稀盐酸和石灰石
(4)制取二氧化碳气体的化学反应方程式为 .
(5)将二氧化碳气体通入饱和氢氧化钠乙醇溶液中,马上有沉淀出现,出现这一现象的原因是 (请用文字表述)

(1)"84消毒液"广泛应用于物体表面的消毒,其有效成分是次氯酸钠。现配制500g溶质质量分数为0.2% 的次氯酸钠溶液,需要固体次氯酸钠的质量是 g,水的质量是 g。
(2)某CO与CO 2的混合气体中碳元素的质量分数为36%,则该混合气体中CO与CO 2的质量比是 (最简比)。
工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁元素的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
[资料1]碱石灰既能吸收水又能吸收二氧化碳;浓硫酸可以吸收水蒸气;
[资料2]实验室常用氢氧化钠溶液来除去CO2反应生成碳酸钠和水;用澄清的石灰水
来检验CO2气体;
[资料3]草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4·3H2O CO2↑+ CO↑+ 4H2O
CO2↑+ CO↑+ 4H2O
(1)下列可用作草酸分解制取气体的装置是 (填字母编号)。

【问题讨论】用下图所示装置进行实验:

A B C D E F
(2)实验前应先 。
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是 、 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)写出A装置中发生的化学反应方程式 。
(5)B装置的作用是 。
(6)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前 。 ②停止加热后 。
(7)写出D装置中所发生反应的一个化学方程式 。
【数据分析与计算】
[资料4]铁的常见氧化物中铁的质量分数:
| 铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 铁的质量分数 |
77.8% |
70.0% |
72.4% |
(8)称取铁红样品10.0 g,用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为m g,则 < m < 。
② 实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是 。
【实验评价】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会 (填“偏小”、“不变”或“偏大”)。
反思2:请指出【问题讨论】中实验装置的一个明显缺陷 。