配制100g质量分数为16%的Na2CO3溶液,用于演示灭火器原理。回答下列问题。
(1)计算Na2CO3的质量为 g,称量Na2CO3的仪器名称是 。
(2)20℃时,Na2CO3的溶解度为21.5g,⑤中的溶液 (填“是”或“不是”)该物质的饱和溶液。
(3)将烧杯中溶液倒入吸滤瓶的操作是 ,从橡胶管喷出大量液体的原因是 。
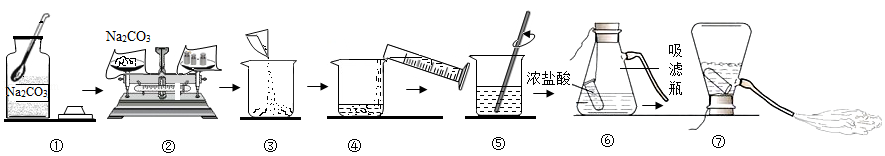
(4)酒精(C2H5OH)可作燃料,在空气中完全燃烧的化学方程式是 。酒精燃烧失火,可用干粉灭火器灭火。NaHCO3是干粉的主要成分,俗称是 。用干粉灭火器灭火的正确操作顺序是 → → (填序号)。
用如图装置在相应条件下完成下列实验

(1)探究燃烧条件:B盛木炭粉。
①由A处通N2一段时间后,加热B,B、C无明显变化。
②待B冷却至室温,由A处通入O2一段时间,B、C无明显变化。
③由A处继续通入O2,加热B,木炭粉燃烧,C中溶液变浑浊。
结论:由①、③可知燃烧需要 ;由②、③可知燃烧需要 。
(2)探究CO与金属氧化物反应:B盛金属氧化物。
I、模拟工业炼铁:A处通CO,B盛Fe2O3粉末,B处下方放酒精喷灯,D处放酒精灯。
实验:在A处通入CO时,应立即点燃 处(填“B”或“D”)酒精(喷)灯。在B处加热一段时间后可观察到的现象是 。
II、探究金属氧化物的组成:A处通CO,B盛金属氧化物,B处下方放酒精喷灯、D处放酒精灯。
已知:CuO、Fe3O4均为黑色物质,B中所盛粉末:CuO或Fe3O4或两者混合物。
实验:同Ⅰ操作、B中可观察到既有红色固体生成,又有黑色固体生成。
实验结论(定性):该黑色粉末为 。
定量分析:经测定反应前B重180克,完全反应后B重170.4克。将反应后B中固体全部加入到足量的稀硫酸中,完全反应后经过滤、洗涤、干燥,测得剩余固体12.8克。
实验结论(定量):m(CuO):m(Fe3O4)= (写最简整数比)。
下面是初中化学中常见的几个基本实验。请回答下列问题。
(1)图A实验中,红磷必须足量的原因是 。
(2)图B实验中可观察到的现象是 。
(3)图C实验是配制氯化钠溶液过程中量取水的操作,该操作将导致所配制的溶液溶质质量分数 (填“偏大”或“偏小”)
(4)图D实验中玻璃棒的作用是 。
(5)图E操作中得到的滤液仍浑浊,其原因可能是 (写一条即可)。
(6)图F实验中,加热片刻后,可观察到棉球上的酒精燃烧而水不燃烧,由此可得出燃烧条件之一是 。
下列是初中化学常见的实验。请回答下列问题
(1)图A所示实验结束后,进入集气瓶中水的体积小于瓶内原气体体积的五分之一,造成该现象的原因是 (答出一条即可)。
(2)图B所示实验观察到木屑先燃烧,燃烧的顺序说明燃烧的条件之一是 。
(3)图C所示实验不能验证质量守恒定律的原因是 。
(4)配制一定质量分数的氯化钠溶液,按图D所示量取溶剂,其他操作均正确,最终导致配制的溶液溶质的质量分数 (填“偏大”、“偏小”或“不变”)。
某实验小组利用如图装置进行“燃烧条件的实验探究”。回答下列问题:

(1)实验前,检验装置A气密性的操作为 ;装置A中发生反应的化学方程式为 。
(2)实验1:将U形管放在盛有80℃热水的烧杯中,关闭K2、打开K1,从U形管左端管口鼓入O2.现象:右端裹有白磷的棉花先冒白烟,片刻后开始燃烧,另一端的普通棉花没有变化。实验1可以得出的燃烧条件为 。
(3)实验2:在上述实验1燃烧过程中,关闭K1、打开K2,从U形管左端管口鼓入气体Y.现象:燃烧着的棉花团很快熄灭,停止燃烧:继续鼓入气体Y,装置C中澄清石灰水变浑浊。写出C中反应的化学方程式 ;装置D中注射器内盛放的试剂X可能为 。
(4)实验3:关闭K2、打开K1,再次鼓入O2,发现右端剩余的裹有白磷的棉花又能燃烧。对比实验2和3,可以得出的燃烧条件为 ;实验2同时能证明气体Y的性质为 ,利用该性质可用于 。
(5)该实验的优点为 。
某课外活动小组进行如下实验探究。

(1)验证物质的燃烧条件
根据图1进行实验,实验现象如图所示。
①80℃热水的作用是 。
②比较现象a、c,得出燃烧的条件是 。
(2)验证锌与铁的金属活动性
①相同条件下,取等质量锌粉、铁粉,根据图2进行实验,实验过程中,观察到锌粉表面产生气泡的速率比铁粉快,由此得到的结论是 。
②实验结束后,发现∪形管两边的金属粉末均无剩余,则硫酸剩余的情况可能是 (填序号)。
A.左、右两边均有剩余 B.左边有剩余,右边无剩余
C.左、右两边均无剩余 D.左边无剩余,右边有剩余
(3)测定水中氢、氧元素的质量比(已知:H2+CuO Cu+H2O)
Cu+H2O)
根据图3进行实验,反应后测得甲中玻璃管(含药品)质量减少ag,乙中U形管(含药品)质量增加bg。

①水中氢、氧元素的质量比是 (用含 a、b的式子表示)。
②下列因素中,对测定结果有影响的是 (填序号)。
A.CuO粉末不干燥 B.CuO没有完全转化为Cu C.没有丙装置
“对比实验”是科学探究常用的方法。根据以下实验回答问题。

(1)图A中,可观察到 (填火焰的名称)处的火柴炭化最明显。
(2)图B中 (填“左”或“右”)边试管发烫。
(3)从图C中可得出燃烧的条件之一是 ,发生反应的化学方程式为 。
(4)图D中打开可乐的瓶塞,可观察到大量气泡冒出,说明气体的溶解度与 有关。
如图是实验室常用的部分实验装置,请按要求回答问题。

(1)写出标有编号的仪器名称:① ,② 。
(2)用加热高锰酸钾的方法制取氧气,所选择的发生和收集装置是 (填字母序号),写出反应的化学方程式 ;检验氧气收集满的方法是 。
(3)将装置B、E、F相连接用于制取二氧化碳气体并验证其化学性质,若E装置中装有饱和碳酸氢钠溶液,则F装置中可观察到的现象:试管中石蕊溶液 ,烧杯中澄清石灰水 。
(4)下列实验的相关说法不正确的是 (填数字序号)。

①甲实验中,红磷要过量
②乙实验中,水中的白磷没有燃烧,是因为白磷没有跟氧气充分接触
③丙实验中,搅拌的目的是防止局部温度过高,造成液滴飞溅
④丁实验开始时,先加热,后通入一氧化碳
实验是进行科学探究的主要方法。如图A~H是初中化学常见的实验装置,请回答:
【查阅资料】常温下,CO2难溶于饱和NaHCO3溶液。
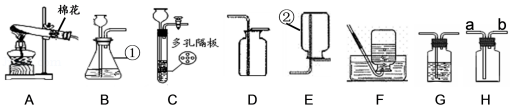
(1)写出仪器名称:① ② ;
(2)写出用装置A制取氧气的化学方程式 ;用双氧水和二氧化锰制取氧气时,选择的发生装置和收集装置的组合是 (写出一种组合即可,填序号);实验室制取氧气时,选择的药品在组成上的共同点是 ;将制得的氧气通入图中,发现只有白磷燃烧,说明燃烧需要满足的条件是 。
(3)实验室用大理石和稀盐酸制取二氧化碳,既可以选用装置B又可选用装置C,相对于装置B,装置C的突出优点是 ;若用装置H收集二氧化碳时,气体应该从 (选填“a”或“b”)端通入;若用装置G除去生成气体中混有的氯化氢气体,则装置G中应盛放 。
下列时初中化学常见的实验装置图,请回答下列问题:

(1)A实验中导致实验结果偏小的原因可能是 ;(写一条)
(2)B实验中玻璃棒的作用是 ;
(3)C实验中铜片上白磷与水下白磷的现象对比可知燃烧的条件之一是 ;
(4)D实验中的操作将导致所配溶液的质量分数 (填“偏大”或“偏小”)
某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验。
[实验一](已知:白磷的着火点为40℃)
实验装置 |
实验步骤及现象 |
|
步骤Ⅰ.检验装置的气密性,气密性良好。 步骤Ⅱ.将盛有白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧。 步骤Ⅲ.向A瓶中加满80℃热水,塞紧瓶塞,白磷不燃烧。 步骤Ⅳ.打开K1、K2,从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2.此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧。 |
(1)对比步骤Ⅱ和Ⅳ的现象可知,可燃物燃烧的条件之一是
(2)待装置冷却一段时间后,打开K2,如果观察到 ,说明空气中氧气的体积约占 .若实验测得空气中氧气的体积分数小于
.若实验测得空气中氧气的体积分数小于 ,原因可能是 (答一条即可)。
,原因可能是 (答一条即可)。
[实验二]用如图所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量。若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气中氧气的含量,并说明理由 。[已知:铜能与空气中氧气、水、二氧化碳反应生成铜绿。化学方程式:2Cu+O2+H2O+CO2═Cu2(OH)2CO3]

探究学习小组的同学利用如图所示的装置进行相关实验,请回答下列问题:

(1)写出图A中任意两种仪器名称 、 .
(2)用图D和图E所示的装置来探究可燃物燃烧的条件
①、薄铜片上的白磷燃烧而红磷不燃烧,说明燃烧需要 ;
②、在水中不燃烧的白磷,通入氧气后燃烧,说明燃烧需要 .
(3)制取氧气的发生装置可选用 (选一个即可),写出相应的化学方程式 .如用C装置收集O 2,则气体应从 端通入(填"a"或"b").
如图是教材燃烧条件探究的实验图,请根据实验回答下列问题。
(1)图中X是 。
(2)铜片上不能够燃烧的物质是 (填名称)。
(3)要使烧杯底部的白磷燃烧起来,需要将 通过导管通入白磷处。

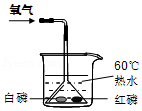
如图是探究燃烧条件的实验装置图,已知白磷和红磷的着火点分别是40℃、240℃.回答下列问题:
(1)该实验主要利用了薄铜片良好的 性
(2)由薄铜片上的白磷燃烧而红磷不燃烧的事实,说明燃烧需要的条件是
(3)燃着的白磷熄灭后,观察到薄铜片上的白色固体周边的铜片表面变黑,该黑色物质是 (填化学式).

小明同学设计以下实验来探究可燃物燃烧的条件和测定空气中氧气的含量.(已知:白磷的着火点是40℃,红磷的着火点是240℃)
| 实验装置 |
实验过程 |
实验现象 |
| |
①取一烧杯,加入适量的生石灰,再分别取少量白磷、红磷放在烧杯上的铜片上. ②… |
一会儿白磷发生燃烧,红磷不燃烧 |
| |
③先在容积为350mL的集气瓶中装进50mL滴有红墨水的水,在燃烧匙中放足量白磷,量筒中盛入足量水. ④按图连好仪器,用激光手电照射白磷,白磷燃烧. |
集气瓶和量筒中的水均为红色,量筒内的液体体积减少约60mL |
(1)实验过程②是 ,烧杯中发生反应的化学方程式为 ;
(2)白磷燃烧反应的化学方程式为 ;
(3)根据实验2的结果,计算空气中氧气的体积分数约为 (写出计算式和结果);
(4)在整个实验2的过程中,集气瓶内的压强变化是 ,集气瓶中预先装入50mL水,水起的作用是 .