(10南昌市24).(6分) 今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见 下表(假设纸张其他成分既不溶于水,也不与水反应):
下表(假设纸张其他成分既不溶于水,也不与水反应):
| |
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
| 加入样品的质量/g |
10 |
10 |
10 |
10 |
10 |
 加入稀盐酸的质量/g 加入稀盐酸的质量/g |
10 |
20 |
30 |
40 |
50 |
| 充分反应后生成气体的质量/g |
0.88 |
1.76 |
X |
3.52 |
 3.52 3.52 |
(1)表中X的值为 ;
(2)求样品中碳酸钙的质量分数;
(3)烧杯④中物质充分反应后所得溶液的质量为 g。
(10广安6).某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
| 反应时间/min |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
| 剩余固体质量/g |
2.55 |
2.25 |
2.10 |
2.04 |
2.04 |
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气的质量为_______________g;
(2)原混合物中氯酸钾的质量分数是多少?(精确到0.1%)
(10茂名19)某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品10.0g放入烧杯中,然后将56.0g溶质质量分数为14.0%的稀硫酸平均分四次依次加入该烧杯中,每次均充分.实验数据记录如下表:
| 编号 |
1 |
2 |
3 |
4 |
| 加入硫酸的质量/g |
14 |
14 |
14 |
14 |
| 剩余固体的质量/g |
8.7 |
7.4 |
6.1 |
6.0 |
试求:
(1)该合金中铜的质量分数是 .
(2)该合金除铜外,另一种金属是什么呢?(写出过程)
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?(写出计算过程,精确到0.1%)
(10宜昌28).鸡蛋壳的主要成分是碳酸钙,为了测定鸡蛋壳中碳酸钙的含量,小丽称取30g干燥的碎鸡蛋壳放入烧杯中,并向其中加入了80g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外的其他成分都不溶于水,且不与稀盐酸反应),反应后烧杯中物质的总质量为101.2g。我能完成下列计算:
⑴碳酸钙的质量;
⑵当碳酸钙恰好完全反应时所得溶液中溶质的质量分数。(结果保留一位小数)
(10,威海13)为了测定某赤铁矿石中氧化铁的质量分数,取矿石样品40g,加入盐酸,恰好完全反应时,共用去盐酸219g,过滤、洗涤、干燥后得滤渣8g(矿石中的杂质既不溶于水也不与盐酸反应)。计算:
(1)赤铁矿石中氧化铁的质量分数;
(2)盐酸的溶质质量分数。
(10泸州17).目前,市场上出现的木糖醇(化学式为C5H12O5)是一种新型甜味剂。它不能被细菌分解,添加在口香糖里取代糖份,可以防止蛀牙。试回答下列问题:
(1)木糖醇属于 (填“有机物”或“无机物”);
(2)木糖醇中碳、氢、氧原子个数比是 ;碳、氢、氧元素质量比是 ;
(3)若将100g木糖醇充分燃烧(化学方程式:2C5H12O5+11O2 10CO2 +12H2O),可生成二氧化碳多少g?(计算结果保留一位小数)
10CO2 +12H2O),可生成二氧化碳多少g?(计算结果保留一位小数)
(10泸州22).在某温度下,将36.5gCaCl2和NaCl的混合物放入236g水中使其完全溶解,再加入132.5g溶质质量分数为20%的Na2CO3溶液,恰好完全反应。(CaCl2+Na2CO3= CaCO3↓+2NaCl)
试计算:(1)生成CaCO3沉淀的质量是多少g? (计算结果保留一位小数)
(2)反应后所得溶液的溶质质量分数是多少g?
将100gNa2CO3溶液和153.7gBaCl2溶液混合后,恰好完全反应,过滤,得滤液的质量为234g。求:
(1)反应后生成的沉淀的质量
(2)过滤所得溶液中溶质的质量分数。
下列五种溶液:①NaOH 溶液、 ②Ba(OH)2溶液、③Na2SO4溶液、④稀硝酸、⑤混有少量硝酸的MgSO4溶液
(1)指出其中属于碱溶液的 (选填序号);
(2)若将Ba(OH)2溶液与Na2SO4溶液混合,产生沉淀质量是116.5克.需要20%的硫酸钠溶液多少克?
(3)若将Ba(0H)2溶液逐滴加人到混有少量硝酸的MgSO4溶液中,所得沉淀的质量与加入的
Ba(OH)2的质量变化符合下列图像的是 (选填序号)·
钢铁的生产和使用是人类文明和社会进步的一个重要的标志。
(1)每年钢铁锈蚀都会造成巨大的损失,铁制品锈蚀的主要原因是
。
(2)校课外兴趣小组的同学们去潍坊某钢铁长生铁样品进行实验:将四份不同质量的生铁样品(假定其中只含单质铁和单质碳)分别加到100g质量分数相同的稀硫酸中,充分反应后,测得的实验数据如下表(已知:在标准状况下,22.4LH2的质量为2g)
| 实验序号 |
1 |
2 |
3 |
4 |
| 生铁样品的质量 / g |
2.88 |
5.76 |
9.24 |
10.28 |
| 生成H2的体积(标准状况下)/L |
1.12 |
2.24 |
3.36 |
m |
通过计算回答下列问题:
①上述表格中m的值为 。
②根据表中数据计算稀硫酸中H2SO4的质量分数。
为测定某碳酸氢铵化肥中的含氮量,小滨在实验室里取用8.5 g该化肥样品与20g NaOH溶液共热,恰好完全反应,测得残留物为26.8 g(提示:反应的化学方程式为NH4HCO3+2NaOH="=" Na2CO3+2H2O+NH3↑,生成的氨气全部逸出,其他成分不含氮,也不参加反应)。试求:
(1)生成氨气的质量。
(2)该化肥中氮元素的质量分数(计算结果精确到0.1%)。
(3)所用溶液的溶质质量分数。
(6分)如图是实验室常用的两个气体制备、收集、净化的多种功能装置。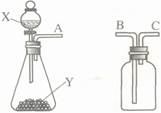
(1)若制备的气体是氢气,且产生的气体中不含酸性杂质气体,则试剂X常用 ▲ ,用图示放置的乙装置收集氢气,A应与 ▲ (填“B”或“C”)相连。
(2)若制备的气体是氧气,Y是黑色粉末,则甲中反应的化学方程式为 ▲ 。若A、C相连制取氧气,检验气密性后,还须将装置乙 ▲ 。
(3)若X是稀盐酸、Y是石灰石,用甲、乙两装置组成发生、净化、收集CO2气体的系列装置。若乙中放入饱和NaHCO3溶液,该溶液的作用是除去 ▲ ;若乙中放入浓硫酸,浓硫酸的作用是 ▲ 。
化学实验操作的先后顺序和试剂的用量常常影响实验的结果。
(1)按操作的先后顺序填空(填序号):
①给试管中的药品加热时,先 ,后 。
A.对准药品部位加热 B.均匀预热
②实验室制备气体时,先 ,后 。
A.检查装置的气密性 B.加入药品
(2)小菌认为NaOH溶液和H2SO4溶液混合时没有明显的现象,无法说明二者是否发生了反应。
①她设计下图实验证明二者之间确实发生了反应,所用的试剂有NaOH溶液H2SO4溶液,CuSO4溶液。请在箭头上方的括号中填入试剂名称,并用“少量”、“足量”等指明试剂的用量。
②如果把CuSO4溶液换成另一种试剂,只要各试剂的用量适当,则不管加入试剂的顺序如何,都能证明二者发生了反应,这种试剂是 。
(8分)某化学课外兴趣小组通过查阅资料知道过氧化钠(Na2O2)能与水反应生成氢氧化钠和氧气,于是他们做了以下探究实验。
实验1:向包有过氧化钠粉末的脱脂棉上滴水,脱脂棉燃烧起来。
请你对脱脂棉燃烧的原因进行分析_______。
实验2:向盛有过氧化钠粉末的试管中加入水,充分反应后,取试管中的少量溶液放入另一小试管中加入几滴无色酚酞试液,溶液变红,过了一会,红色又褪去了。
【提出问题】溶液为什么先变红,过了一会,红色又褪去了呢?
【猜想】甲同学认为是氢氧化钠溶液与空气中的二氧化碳反应的缘故。乙同学认为甲同学的猜想不正确,理由是_____________________。
【查阅资料】①滴加酚酞呈现红色的溶液遇到H2O2时,H2O2可以破坏酚酞的结构,使酚酞在碱性溶液中不能再显红色;②酚酞在稀碱性溶液中稳定显红色,而在浓氢氧化钠等溶液中显红色后又褪色。
【猜想】通过查阅资料后,该兴趣小组对溶液的红色褪去的主要原凶义进行了猜想。
猜想A:过氧化钠与水反应可能生成了H2O2;猜想B:生成的氢氧化钠溶液可能太浓。
【实验探究】请你将下列实验方案填写完整。
| 猜想 |
实验操作 |
实验现象 |
结论 |
| A |
取过氧化钠与水反应后的溶液放入试管中,_____ ___________________________________________ |
_________________ |
猜想A 正确 |
| B |
取过氧化钠与水反应后的溶液放入试管中, ________________________________________ |
________________ |
猜想B 错误 |
【得出结论】根据实验分析,过氧化钠与水反应除了生成氢氧化钠和氧气外,还存在另一反应,则另一反应的化学方程式为____________________________________。
(12分)化学实验是学习化学的基础,请根据下列装置图回答问题。
A B C
(1)写出仪器a、b的名称_______;b_______。
(2)写出A图中产生气体的化学方程式____________________________。
(3)B图中,把二氧化碳气体慢慢倒入放有燃着的蜡烛的烧杯中,下层蜡烛先灭,说明二氧化碳具有_______、_______和_______性质。这一性质在实际生活中的应用为_______。
(4)C图中螺旋状铁丝的末端系一根火柴的作用是_______。
(5)小明按C图实验时,集气瓶炸裂了,其可能的原因是_______。
(6)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录。请你分析回答:
| 物质 |
镁条 |
含碳0.05%的铁丝 |
含碳0.2%的铁丝 |
含碳0.6%的铁丝 |
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
剧烈燃烧 少量火星 |
(未填) |