2010年全国中考真题专题汇编专题六 化学方程式计算(三)
(10佛山) 2009年底武广高速铁路的开通,标志着我国铁路事业进入一个崭新的时代。铺设无缝钢轨。需要用大量的钢铁。钢铁在生活中应用非常广泛,认识铁的有关知识很有意义。结合所学知识,完成27、28题。
(27).(10佛山27)铁有多种氧化物,根据下列信息推断它们的化学式:
(1)某铁的氧化物中铁元素的化合价为+3价,氧元素的化合价为-2价,则该铁的氧化物的化学式为 。
(2)某铁的氧化物化学式为FexOy,相对分子质量为72,则该铁的氧化物的化学式为 。
(3)某铁的氧化物可还原得到铁,化学方程式为 +4CO
+4CO  3Fe + 4CO2,则“
3Fe + 4CO2,则“
”中铁的氧化物的化学式为 。
(10佛山28)为了分析生铁中铁的含量,某学习小组进行了实验研究,即取6g生铁与10%的盐酸反应,并绘制了加入盐酸质量与放出气体质量的关系图(见右下图)。说明:生铁中杂质不溶于水,不与盐酸、硫酸铜溶液反应。
(1)铁完全反应用去盐酸的质量为 g。
(2)生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)
(3)某同学列出了如下计算式:
生铁与盐酸刚好反应完全时所得溶液质量= (73+6-a)g
小明对该计算式提出了质疑,请指出其中的错误
(4)小华另设计了一个实验方案,即用6g生铁粉与20%的硫酸铜溶液反应来分析生铁中铁的含量。请你画出加入硫酸铜溶液质量与固体质量变化关系的曲线(见答题卡)。
(10江西30)今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
| |
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
| 加入样品的质量/g |
10 |
10 |
10 |
10 |
10 |
| 加入稀盐酸的质量/g |
10 |
20 |
30 |
40 |
50 |
| 充分反应后生成气体的质量/g |
0.88 |
1.76 |
2.64 |
3.52 |
3.52 |
(1)10g样品与足量稀盐酸反应最多生成 g气体;
(2)求样品中碳酸钙的质量分数;
(3)烧杯④中物质充分反应后所得溶液的质量为 g。
.(10湖北省恩施市16)已知 Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCI 组成的固体混合物。向其中逐渐滴加溶质质分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH 7(填>、=、<)。
(2)当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)
(10湖北省黄石市24)将11g含少量杂质(杂质不溶于水,也不溶于酸)的碳酸钠固体,加入到43.8g盐酸溶液中,恰好完全反应,产生CO2气体4.4g,请计算:
(1)原固体中Na2CO3的质量;
(2)反应后的溶液中氯化钠的质量分数。
(10武汉33).某化学活动小组用稀盐酸对赤铁矿Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液。为防止直接排放造成环境污染,对其组成进一步进行探究。过滤该残液,取100 g滤液,向基中不断加入5%和氢氧化钠溶液,所得实验数据如下表:
| 加入氢氧化钠的溶液的质量/g |
20 |
40 |
60 |
80 |
160 |
180 |
| 生成沉淀的质量/g |
0 |
0 |
0.80 |
1.78 |
5.35 |
5.35 |
(1)通过对上述实验数据的分析,该滤液中含有的溶质是--------------(写化学式)。
(2)选择合理的数据,计算100 g滤液中溶质的质量(若有多种溶质,任选一种。结果精确到0.01g)。可能用到的相对原子质量:H—1 O—16 Na —23 Cl—35.5 Fe —56
(10本溪26).(5分)生产烧碱的工厂,常用便宜的原料纯碱和熟石灰制得成品。为模拟该生产过程,同学们取20gNa2CO3溶液与一定质量的饱和石灰水混合,恰好完全反应,得到4g白色沉淀。求Na2CO3溶液中溶质的质量分数。
(10,绵阳29)质量分数不同的硫酸溶液其密度不相同,对照表如下:
| 质量分数 |
10% |
20% |
30% |
40% |
50% |
60% |
70% |
80% |
90% |
98% |
| 密度(g/mL) |
1.07 |
1.14 |
1.22 |
1.30 |
1.40 |
1.50 |
1.61 |
1.73 |
1.81 |
1.84 |
将10mL98%浓硫酸中加水稀释至100ml,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
(1)10mL98%的浓硫酸中含_________gH2SO4。
(2)列式计算消耗金属锌的质量。
(3)分析表中数据,可以归纳出硫酸溶液的质量分数与密度的关系是 。10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在 至 之间。
(10广安6).某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
| 反应时间/min |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
| 剩余固体质量/g |
2.55 |
2.25 |
2.10 |
2.04 |
2.04 |
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气的质量为_______________g;
(2)原混合物中氯酸钾的质量分数是多少?(精确到0.1%)
(10张家界29)、颗粒氧是养鱼专业户常常用到的物质,其主要成分是过氧化钙(化学式为CaO2)。取颗粒氧10g,加入到足量的水中,共生成1.6g氧气(假定只有过氧化钙与水反应)。请你计算出该颗粒氧中过氧化钙的质量分数?
颗粒氧与水反应的原理:[ 2CaO2+2H2O=2Ca(OH)2+O2 ↑]
(10揭阳23).(6分)将一定量的CO2缓缓通入足量的澄清石灰水中,随时间的进行生成的沉淀质量如右图所示,回答下列问题:
(1)反应达到t时生成的沉淀质量为 g
(2)若改为碳酸氢钠与足量的澄清石灰水反应为,生成相同质量的沉淀,则需要的碳酸氢钠固体的质量为多少克?提示反应的化学方程式为: NaHCO3+Ca(OH)2==CaCO3↓+NaOH+H2O
(10南昌市24).(6分) 今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见 下表(假设纸张其他成分既不溶于水,也不与水反应):
下表(假设纸张其他成分既不溶于水,也不与水反应):
| |
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
| 加入样品的质量/g |
10 |
10 |
10 |
10 |
10 |
 加入稀盐酸的质量/g 加入稀盐酸的质量/g |
10 |
20 |
30 |
40 |
50 |
| 充分反应后生成气体的质量/g |
0.88 |
1.76 |
X |
3.52 |
 3.52 3.52 |
(1)表中X的值为 ;
(2)求样品中碳酸钙的质量分数;
(3)烧杯④中物质充分反应后所得溶液的质量为 g。
(10肇庆市25).某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0 g石灰石样品,把25.0g质量分数为10%的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
| 实验次数 |
1 |
2 |
3 |
4 |
5 |
| 稀盐酸的累计加入量 |
5.0g |
10.0g |
15.0g |
20.0g |
25.0 g |
| 剩余固体的质量 |
1.5g |
1.0g |
0.5g |
0.3g |
0.3g |
请计算:
(1)2.0g石灰石样品中碳酸钙的质量为 ,石灰石中碳酸钙的质量分数为 。
(2)请你继续计算反应生成溶液中氯化钙的质量分数(计算过程和结果均保留一位小数)。
(10,娄底31)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
| |
加入稀硫酸的质量(g) |
充分反应后剩余固体的质量(g) |
| 第1次 |
20 |
17.4 |
| 第2次 |
20 |
14.8 |
| 第3次 |
20 |
12.2 |
| 第4次 |
20 |
12.0 |
| 第5次 |
20 |
m |
试回答下列问题:
(1)上述表格中m的值为 70 ;
(2)黄铜样品中锌的质量分数为 71 ;
(3)所用稀硫酸中硫酸的质量分数是多少? 72
(10陕西23).我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石。用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为: 3CO+ Fe2O3高温2Fe + 3CO2 。
(1)上述反应不是置换反应的理由是: 。
(2)Fe2O3中铁元素的质量分数: _________
(3)根据化学方程式计算:用含Fe2O360%的赤铁矿石800 t,理论上可炼出纯铁多少吨?
(10福建南安23.)某氯碱化工厂以电解食盐水产生化工原料氢氧化钠(反应原理为:2NaCl+2H2O 2NaOH+H2
2NaOH+H2 +Cl2
+Cl2 )。若电解含氯化钠23.4t的食盐水,理论上可得到多少氢氧化钠?
)。若电解含氯化钠23.4t的食盐水,理论上可得到多少氢氧化钠?
(10福建省晋江21.).氢化钙(CaH2)固体是登山运动员常用的能源提供剂,用它与水反应生成氢气供燃烧之需,反应的化学方程式为:CaH2 + 2H2O = Ca(0H)2 + 2H2↑。
(10福建省福州19.)实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,设计了实验,实验过程如下:
实验一:取少量样品于试管中,滴加适量稀盐酸,观察到有气泡产生,说 明氢氧化钠已变质,变质的原因是___________________________(用化学方程式表示)。
明氢氧化钠已变质,变质的原因是___________________________(用化学方程式表示)。
实验二:
通过实验二,能进一步推算出氢氧化钠变质的程度。请计算实验二中参加反应的碳酸钠质量。(化学方程式:Na2CO3+ CaC12=CaCO3↓+2NaCl)
结论:16.0 g干燥的样品中已变质的氢氧化钠的质量是 g。
(10内江13)某实验工作人员为了确定小苏打样品的纯度,现称取200g该小苏打样品充分加热(杂质不反应)后冷却到室温,测得实验过程中剩余固体质量随时间变化关系如下:
(1)固体质量减少是因为生成了_________;最终固体减少的质量为_________g。
(2)试计算200g样品中含碳酸氢钠多少克?
(3)样品中小苏打的纯度为多少?
(10南充18)下图是某种胃药的部分标识。胃药中所含物质能中和胃液里过多的胃酸(主要是盐酸)。
某患者按标识上的服用方法服药,服药三天后病情好转。请计算患者在三天内所服的此胃药中:(计算结果保留一位小数)
(1)所含氢氧化镁的质量为多少?
(2)理论上可中和胃酸中的HCl质量是多少?
某校兴趣小组探究学校附近赤铁矿中Fe2O3的纯度。他们采集了80g矿样,粉碎后均分成四等份,分别置于四个烧杯中,然后分别向四个烧杯中加入同一浓度的稀硫酸,加入硫酸的质量与反应后剩余固体质量如下表所示。(假设矿石中的杂质既不和稀硫酸反应,也不溶于水)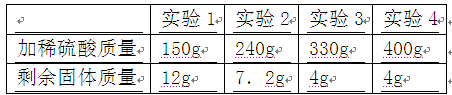
求:(1)该矿样中Fe2O3的质量分数。
(2)所用稀硫酸的溶质质量分数。
我国钢铁产量居全球第一,占全球总产量的30%以上。某兴趣小组到钢铁厂做社会调查,取钢样(假设只含铁和碳)进行实验。他们向组成完全相同的四份钢样粉末中分别加入100g稀H2SO4溶液,充分反应后,测得的实验数据如下表所示:
| |
实验l |
实验2 |
实验3 |
实验4 |
| 钢样粉末质量 |
2.84g |
4.26g |
6.23g |
7.5lg |
| 生成H2的质量 |
0.10g |
0.15g |
0.20g |
0.20g |
请计算:稀硫酸完全反应的实验中,反应后溶液中溶质的质量分数是多少?(结果保留至0.1%)
小丽同学在整理实验台时,发现一瓶敞口放置的氢氧化钠固体,小丽猜想该瓶氢氧化钠可能因与空气中的二氧化碳反应而部分生成了碳酸钠(Na2CO3)。为了验证自己的猜想和测出样品中氢氧化钠的质量分数,小丽做了如下实验:取该样品l0.0g配成溶液,加入足量澄清石灰水,得到白色沉淀5.0g。
(1)请你帮助小丽计算出该瓶样品中氢氧化钠的质量分数。
(2)若取该样品溶于一定量水中,得到200g氢氧化钠的质量分数为l8.8%的溶液,则所取样品的质量为____________g,所需水的体积为____________mL。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号