为了测定某小苏打样品中碳酸氢钠的质量分数,小兰同学进行了如下实验:向盛有10g样品的烧杯中加入稀硫酸,恰好完全反应时,加入稀硫酸的质量为90g,反应后烧杯内物质的总质量为95.6g。(杂质不溶于水也不与酸发生反应)
已知反应的化学方程式如下:2NaHCO3+H2SO4═Na2SO4+2CO2↑+2H2O
(1)该反应生成二氧化碳的质量为 g。
(2)求该样品中碳酸氢钠的质量分数(写出计算过程)。
我国著名的化学家侯德榜发明了联合制碱法,大大提高了原料的利用率,其反应原理之一为NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,某化工厂消耗117t氯化钠,理论上可生产碳酸氢钠的质量是多少?
(注:在20℃时,将二氧化碳通入含NH3的饱和NaCl溶液中能生成 NaHCO3晶体和NH4Cl溶液)
向表面生锈的铁片中滴加稀硫酸,产生氢气的质量与所加稀硫酸的质量关系如图所示,请回答:
(1)从图中可以看出完全反应后产生氢气的质量为 g。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)
国家明令禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。过氧化钙是一种安全无毒物质,常带有结晶水,广泛用于果蔬保鲜、空气净化、污水处理等方面。某化学兴趣小组为测定某过氧化钙样品(CaO2•xH2O)中的结晶水,称取4.86g过氧化钙样品,灼热时发生如下反应:
2[CaO2•xH2O] 2CaO+O2↑+2xH2O
完全反应冷却后称量,得到剩余固体的质量为3.36g。
(1)反应中生成O2的质量是 g。
(2)计算样品CaO2•xH2O中的x值(写出详细的计算过程)。
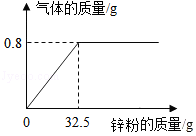
某化学兴趣小组的同学进行了如图所示实验。

请根据图示信息计算:
(1)实验中产生氢气的质量是 g。
(2)实验中所用稀硫酸溶质的质量分数是多少(要求书写计算过程)?
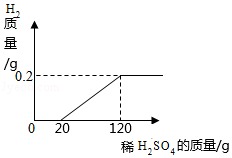
向一定量的稀硫酸中加入锌粉(仅含不溶于酸的杂质),所加锌粉的质量与产生气体的质量的关系如图所示。求:
(1)此过程中产生氢气的最大质量是 克。
(2)锌粉中锌的质量分数为多少。(请写出计算过程)
小华同学发现自家的水壶用久以后底部会附着一层白色固体,查阅资料后得知,水在加热或长久放置时,溶于水中的可溶性钙和镁的化合物会生成沉淀(水垢),于是他邀请同学小雪进行了以下实验探究。
探究一:自家的井水是软水还是硬水?
取少量井水样品于试管中,加入 ,振荡,出现大量浮渣,由此得出结论:自家的井水属于 。
探究二:白色固体的主要成分是什么?
[假设与猜想]猜想Ⅰ:CaCO3。
猜想Ⅱ: (填化学式)。
猜想Ⅲ:CaCO3和Mg(OH)2。
[实验与探究]取少量白色固体样品(不考虑杂质和微溶物对实验的影响)于试管中,向其中加入足量稀盐酸,白色固体溶解,有 产生,根据以上现象,小华认为:猜想Ⅰ正确。小雪认为小华的结论不严谨,理由是 。经过两人反复讨论,进一步设计了如下实验。
实验步骤 |
实验现象 |
实验结论 |
取上述实验中的上层清液于试管中,滴加足量NaOH溶液 |
无明显现象 |
猜想Ⅰ成立 |
|
猜想Ⅲ成立 |
[拓展与迁移]取含有MgCl2和HCl的混合溶液165.8g于烧杯中,向其中缓慢加入200g溶质质量分数为8%的NaOH溶液,恰好完全反应后过滤得到沉淀和滤液,其中滤液的质量为360g。请计算:
(1)生成沉淀的质量是 克。
(2)原混合溶液中,MgCl2的质量是多少?(请写出具体的计算过程,下同)
(3)恰好完全反应时,所得溶液的溶质质量分数是多少?(结果保留至0.1%)
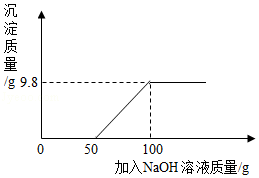
某学校化学实验室有一杯含盐酸和氯化铜的废液,该校化学兴趣小组的同学取109.8g废液于烧杯中,向其中逐滴加入一定溶质质量分数的氢氧化钠溶液,所加氢氧化钠溶液与生成沉淀的质量关系如图所示:
试计算:
(1)产生沉淀的总质量是 克;
(2)109.8g废液中氯化铜的质量是 克。
(3)计算加入100g氢氧化钠溶液并充分反应后烧杯内所得溶液中溶质的质量分数。
随着人类现代化程度迅速提高,温室气体(CO2)排放日益增加,为降低温室气体含量,科学家正在研究一种新型的“人造树叶”。假设每1升“人造树叶”每天可从空气中吸收二氧化碳880g并转化为乙醇(C2H5OH),对应化学方程式为2CO2+3H2O C2H5OH+3O2.请回答:
(1)写出该研究的一点意义 。
(2)若每天一棵树平均可吸收44g CO2,则一升“人造树叶”一天吸收的CO2相当于 棵树吸收的CO2。
(3)1升“人造树叶”工作一个月(按30天计)可得到乙醇多少克?(写出计算过程)。
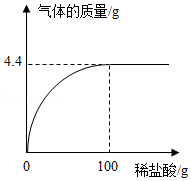
鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,取12.5g干燥的鸡蛋壳,捣碎,放在烧杯中,然后向其中滴加某浓度的稀盐酸,滴加过程中产生气体质量与所加稀盐酸质量的关系如图所示(鸡蛋壳中除CaCO3外的其他成分都不溶于水,也不与稀盐酸反应)。试计算:
(1)产生CO2的质量为 g;
(2)该鸡蛋壳中CaCO3的质量分数;
(3)所用稀盐酸溶质的质量分数。
某化学兴趣小组利用如图装置进行Fe与水蒸气反应的实验:

(1)A装置的作用是 ,点燃C中产生的肥皂泡,有的发出轻微的爆鸣声,有的可以被点燃,请你推断反应生成的气体是 ;
(2)有同学认为导管口有气泡产生即说明反应生成了气体,你认为是否正确 (填“是”或“否”),请说明理由 ;
反应一段时间后,学习小组对反应后的黑色固体产生了浓厚的兴趣,并查阅了相关资料:铁粉(黑色),Fe2O3(红棕色)、FeO(黑色)、Fe3O4(黑色)。学习小组进行了一系列实验,验证了FeO不存在,然后对黑色固体的成分进行了以下猜想:
猜想一:只有铁粉
猜想二:只有Fe3O4
猜想三:铁粉和Fe3O4的混合物
学习小组设计了实验进行验证,请回答以下问题:
(3)取少量黑色粉末于试管中,加入足量的稀盐酸,有气泡产生,说明猜想 不成立;
(4)通过实验测得,34.4g黑色固体与足量的稀盐酸反应,产生了0.2g H2,说明猜想 成立;
(5)另取34.4g黑色固体在高温条件下与足量的CO反应,充分反应后,固体质量变为28.0g,请计算在黑色固体中Fe3O4的质量分数为 (计算结果精确到0.1%);
(6)根据以上探究,请写出Fe与水蒸气反应的化学方程式 。
向一定量的澄清石灰水中通入适量的二氧化碳,使氢氧化钙全部转化为碳酸钙沉淀,得到的沉淀质量为1.00g。计算澄清石灰水中氢氧化钙的质量(计算结果精确至0.01g)。
为测定某赤铁矿中Fe2O3的含量,取10g该赤铁矿样品于烧杯中,向其中加入100g稀盐酸,恰好完全反应,测得剩余固体的质量为2g。(杂质不溶于水也不与酸反应)
请完成下列分析及计算:
(1)10g样品中杂质的质量为 g。
(2)计算稀盐酸中溶质的质量分数。
农业生产上常用一定溶质质量分数的氯化钠溶液进行选种。实验小组取该溶液36g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35g。
(1)配制选种所用氯化钠溶液的步骤:计算、称量、 、溶解。
(2)计算该氯化钠溶液中溶质的质量分数(写出计算讨程)。