下列离子方程式与所述事实相符且正确的是( )
A.实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓) Mn2++2Cl﹣+Cl2↑+2H2O Mn2++2Cl﹣+Cl2↑+2H2O |
| B.Ca(HCO3)2溶液中加入少量烧碱溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| C.向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓ |
| D.向次氯酸钠溶液中通入SO2:2ClO−+SO2+H2O=SO32-+2HClO |
常温下在下列溶液中发生如下反应:由此判断下列说法正确的是( )
①16H++10Z-+2XO4-==2X2++5Z2+8H2O ②2A2++B2===2A3++2B- ③2B-+Z2==B2+2Z-
| A.反应Z2+2A2+==2A3++2Z-不能进行 |
| B.Z元素在①③反应中均被氧化 |
| C.还原性由强到弱的顺序是A2+、B-、Z-、X2+ |
| D.氧化性由弱到强的顺序是XO4-、Z2、B2、A3+ |
溶液中存在有五种离子,其中各离子个数比Cl-∶SO42-∶Fe3+∶K+∶M=2∶3∶1∶3∶1,则M为( )
| A.CO32- | B.Mg2+ | C.Na+ | D.Ba2+ |
对下列事实的解释正确的是 ( )
| A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸具有不稳定性 |
| B.浓硫酸具有吸水性,说明可用浓硫酸干燥氨气 |
| C.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+ |
| D.常温下,可用铝制容器盛装浓硫酸,说明浓硫酸与铝不反应 |
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),反应结果并不改变的是 ( )
| A.Na和O2 | B.Cu和硝酸 | C.Cu和硫酸 | D.Al和NaOH |
用10mL的0.1mol/L BaCl2溶液恰好可使相同体积的硫酸铝、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
| A.3:2:2 | B.1:3:3 | C.2:3:6 | D.3:1:1 |
氮化铝(AlN)具有耐高温.抗冲击,导热性好等优良性质,被广泛应用于电子工业.陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3C  2AlN + 3CO下列叙述正确的是( )
2AlN + 3CO下列叙述正确的是( )
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 |
| B.氮化铝是铝合金中的一种 |
| C.上述反应中每生成2molAlN,N失去6mol电子 |
| D.氮化铝中氮元素的化合价为-3 |
下列实验过程中出现的异常情况,其可能原因分析错误的是( )
| 选项 |
异常情况 |
可能原因分析 |
| A |
蒸发结晶:蒸发皿破裂 |
将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 |
| B |
分液:分液漏斗中的液体难以滴 下 |
没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C |
萃取:液体静置不分层 |
加入萃取剂的量较多 |
| D |
蒸馏:冷凝管破裂 |
冷凝管没有通水或先加热后通水 |
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl﹣、CO32﹣、OH﹣这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
| A.Cu2+、 H+、 Cl﹣ | B.K+、OH﹣、CO32﹣ |
| C.CO32﹣、OH﹣、Cl﹣ | D.K+、H+、Cl﹣ |
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )


下列说法正确的是( )
| A.二氧化硅溶于水显酸性 |
| B.二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到白色胶状物质 |
| C.因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 |
| D.二氧化硅是酸性氧化物,它不溶于任何酸 |
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是 (用离子方程式表示),FeCl3净水的原理是 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+) = 1.0 × 10-3 mol·L-1 , c(Cl-) = 5.3 × 10-2 mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  Fe2++
Fe2++ ClO3-+
ClO3-+  =
=  Fe3++
Fe3++ Cl-+
Cl-+ 。
。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O 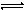 Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O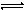 Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O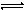 Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O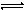 Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是 (填序号)。
| A.加水稀释 | B.降温 | C.加入NH4HCO3 | D.加入NH4Cl |
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
某小组同学用下图装置进行实验研究(a、b、c表示止水夹)。请评价或完善其方案:

(1)将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①A中反应的离子方程式:_ 。
②E中氢氧化钠溶液的作用 。在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
| 实验序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将氯水滴入品红溶液 |
品红溶液褪色 |
氯气有漂白性 |
| Ⅱ |
氯水中加入碳酸氢钠粉末 |
有无色气泡产生 |
氯气与水反应的产物具有酸性 |
③实验Ⅰ推出的相应结论是否合理?________,若不合理,请说明理由(若合理,无需填写)____________。
④实验Ⅱ推出相应的结论是否合理?_______,若不合理,请说明理由(若合理,无需填写)_____________。
(2)将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2并进行有关实验。
①B中反应的化学方程式________________________。
②先若关闭c,当丁中充满红棕色的NO2时,再关闭止水夹a、b ,微热试管丁,丁中可观察到的实验现象 。
合成氨工业中氢气可由天然气和水蒸汽反应制备,其主要反应为:
CH4+ 2H2O 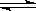 CO2+4H2,已知:
CO2+4H2,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890KJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ/mol
H2O(g)=H2O(l) △H=-44KJ/mol
(1)写出由天然气和水蒸汽反应制备H2的热化学方程式: 。
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生CH4(g)+ 2H2O(g) 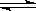 CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则①平衡时,CH4的转化率为 ,H2的浓度为 ,反应共放出或吸收热量 KJ。
②升高平衡体系的温度,混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)。
③当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
④若保持恒温,将容器压缩为5L(各物质仍均为气态),平衡将 (填“正向”“逆向”或“不”)移动。达到新平衡后,容器内H2浓度范围为 。
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
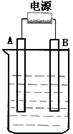
(1)A接的是电源的 极,B是该装置 极,B电极反应式为 。
(2)写出电解时反应的总离子方程式 。
(3)电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态,则需加入 ,其质量为 。(假设电解前后溶液的体积不变)
(4)MnO2可作超级电容器材料。用惰性电极电解酸性MnSO4溶液可制得MnO2,其阳极的电极反应式是____________________