(除标注外,每空2分,共8分)如下图所示:化合物A只含两种元素,C为白色胶状沉淀,B、F为刺激性气体,且F能使品红溶液褪色,E为金属单质,J、K为非金属单质,化合物H和L为常见化工产品,化合物I常温下为液态,H的浓溶液与K加热能生成F和无色无味气体M(图中反应条件和部分产物已略去)。

试回答下列问题:
(1)写出A、M的化学式:A_____;M__ _。
(2)写出反应①、②的化学方程式:
__ __;_ _ _。
(3)写出E→D反应的离子方程式:_ __。
醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为:

醋硝香豆素可以通过以下方法合成(部分反应条件省略)。

已知: + H2O
+ H2O
回答以下问题:
(1)反应的反应类型是 。
(2)从A到B引入的官能团名称是 。
(3)反应‚的化学方程式为 。
(4)反应ƒ的化学方程式为 。
(5)关于E物质,下列说法正确的是 (填字母序号)。
a.在核磁共振氢谱中有四组吸收峰
b.可以用酸性高锰酸钾溶液鉴别D和E
c.可以发生加成反应、聚合反应、氧化反应和还原反应
d.存在顺反异构
(6)写出G的结构简式 。
(7)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有 种。
可与氯化铁溶液发生显色反应;
‚可与碳酸氢钠溶液反应生成二氧化碳气体。
其中,苯环上的一氯代物只有两种的同分异构体的结构简式为 。
已知X为Fe2O3和CuO的混合物,且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X 样品可发生如图所示的转化关系:
(1)写出步骤③可能发生反应的离子方程式(共有3个)__________。
(2)若溶液E中只有一种金属离子,则一定是_________________________;
若溶液E中含有两种金属离子,则一定是______________________。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式_________________________。
如下对甲、乙、丙三种物质的说明:

(1)甲中含氧官能团的名称为 。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):

其中反应Ⅰ的反应类型为 ,反应Ⅱ的化学方程式为 (注明反应条件)。
(3)已知:

由乙制丙的一种合成路线图如下(A﹏F均为有机物,图中Mr表示相对分子质量):

① 下列物质不能与C反应的是 (选填序号)
a. 金属钠 b.HBr c.Na2CO3溶液 d. 乙酸
② 写出F的结构简式
③ D有多种同分异构体,其中一种既能发生银镜反应又能发生水解反应的结构简式 其
④综上分析,丙的结构简式为
利用芳香烃X和烯烃Y可以合成紫外线吸收剂BAD。
已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(—COOH)的反应。其中BAD结构简式为:
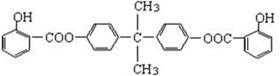
BAD的合成路线如下:

试回答下列问题:
(1)写出结构简式:Y ,D 。
(2)上述属于取代反应的有 (填数字序号)。
(3)1molBAD最多可与含 molNaOH的溶液完全反应。
(4)写出下列反应的化学方程式,注明反应条件:反应④
B+E
(5)E有多种同分异构体,判断符合下列要求的同分异构体数目为 种。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③核磁共振氢谱图中有四个吸收峰
Methylon(l,3-亚甲基双氧甲基卡西酮)的一种合成路线如下:
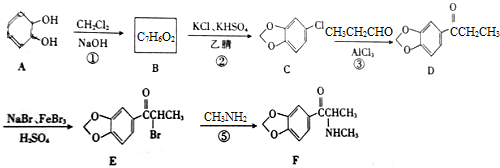
(1)A的分子式为 ;B的结构简式为 。
(2)D中含氧官能团的名称为______________。
(3)反应⑤的反应类型是____________。
(4)B的同分异构体中能同时满足下列条件的共有 种(不含立体异构)。
a.属于芳香族化合物 b.能与NaOH溶液反应 c.结构中除苯环外不含其他环状结构
其中核磁共振氢谱显示只有4组峰,且不能发生银镜反应的同分异构体是 (填结构简式)。
(5)参照上述Methylon的合成路线并结合已学知识,设计一种以苯和乙醛为原料制备香料2羟基苯乙酮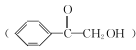 的合成路线。
的合成路线。
X、Y、Z、W四种常见化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去):
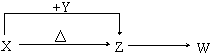
请回答:
(1) W的化学式是 。
(2) X与Y在溶液中反应的离子方程式是 。
(3) ①将4.48 L(已折算为标准状况)W通入100 mL 3 mol/L的Y的水溶液后,溶液中的溶质是 。
②自然界中存在X、Z和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为 g。
已知有以下物质相互转化,已知,A是世界上用量最大的金属单质:

试回答:(1)写出E的化学式 ,F的化学式
(2)写出由E转变成F的化学方程式 。颜色变化_________________
(3)向G溶液加入A的有关离子反应方程式________________________________。
(4)写出G溶液中阳离子的鉴别方法(一种,要求写现象)____________________
(5)写出B溶液转变成G溶液的方程式_______________________________
如图,已知有以下物质相互转化

(1) A转化为B及气体这步反应中应加入的试剂是(填化学式) ,C溶液中溶质的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出检验G溶液中阳离子的离子方程式 ;向G溶液中加入A的有关离子反应方程式是 。
(4) 有一瓶存放时间较长的B溶液,某学生怀疑其有部分因氧化而变质,如果有变质,应如何除去变质的杂质? 。
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:

已知一个B分子中含有的Z元素的原子个数比C
分子中的少一个。请回答下列问题:
(1)Y单质分子的电子式为 。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入 (填物质名称或化学式均可);负极电极反应式为 。
(3)已知Y的单质与Z的单质生成C的反应是可逆反应,将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是__________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小
有机物Ⅰ可以用E和H在一定条件下合成如图:

请根据以下信息完成下列问题:
①A为丁醇且核磁共振氢谱有2种不同化学环境的氢;
②R﹣CH=CH2 R﹣CH2CH2OH
R﹣CH2CH2OH
③一个碳原子上连有两个羟基不稳定,易脱水形成羰基.
(1)B的分子式为: .
(2)C→D、G→H的反应类型为 、 .
(3)芳香族化合物F的分子式为C7H8O,苯环上的一氯代物只有两种,则F的结构简式为: .
(4)D生成E的化学方程式为 .E与H反应生成I的方程式为 .
一种固体物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成。为检验它们,做了以下实验。
(1)将固体物溶于水,搅拌后得到无色透明溶液;
(2)取此溶液适量,向其中滴加过量的硝酸钡溶液,有白色沉淀生成;
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
试判断:
固体物中肯定有________,肯定没有____________________,可能有________,对可能有的物质,可采用向滤液中滴加________溶液的方法来检验。
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
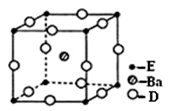
(4) D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。
(5)纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
聚合物F的合成路线图如下:


请据此回答:
(1) A中含氧官能团名称是_______,C的系统命名为_________。
(2) 检验B中所含官能团所用的试剂有______;E→F的反应类型是___________。
(3) G物质的相对分子质量比 的相对分子质量大2,则符合下列条件的G的同分异构体有__ __种。
的相对分子质量大2,则符合下列条件的G的同分异构体有__ __种。
① 分子中含有苯环,且苯环上有两个取代基 ② 遇氯化铁溶液变紫色
(4) C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为_______________。
(5) 参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备  的合成路线 。
的合成路线 。