有机物A是分子式为C7H8O2的五元环状化合物,它具有四种不同化学环境的氢,其原子个数比为3:1:2:2它能发生如下转化:
根据以上信息,试回答下列问题:
(1)写出化合物A中官能团的名称 。
(2)写出化合物B、F的结构简式B F 。
(3)A→B的反应类型是 ,F→G的反应类型是 。
(4)①写出D与CH4O反应的化学方程式 。②写出F→G的反应的化学方程式 。
(5)写出化合物A的符合下列条件的同分异构体 。
①属于芳香族化合物 ②能与碳酸钠溶液反应 ③属于醇类化合物
下表为部分短周期元素化合价及其相应原子半径的数据。请回答下列问题: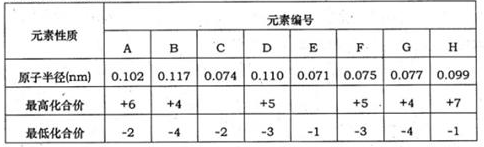
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 。
(2)A、B、C、E的氢化物稳定性顺序是 。(用化学式回答)
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)请写出B的单质的一种重要用途 ;工业上制取该单质的原理反应为 。
(5)请设计一个实验方案,使铜和A的最高价氧化物对应的水化物的稀溶液反应,得到蓝色溶液和氢气。请在方框内绘出该实验方案原理装置示意图。
A-E是周期表中1一36号的元素,它们的原子序数依次递增且分别位于前四周期的各个周期中。对它们的性质及结构的描述如下。
A原子的基态只有一种形状的电子云,并容易形成共价键;B原子的最外电子层的电子排布可表示为nsnnpn,其元素最高正化合价与最低负化合价的代数和为0;C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素;D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素。
(1)请写出E原子基态的电子排布式____________。
(2)A与C形成的最简单化合物(甲)分子的立体结构是____________,其中C原子的杂化方式是______
(3)A与D元素形成的化合物(乙)与甲相比,沸点较低的是(写化学式)____________原因是________________________
(4)B元素可形成B70单质,它在一定条件下吸收可见光后可高效杀灭癌细胞,有望成为癌症治疗药物的候选材料。它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为______。
格隆溴铵具有解痉、减少胃酸分泌等作用,用于治疗胃及十二指肠溃疡,合成路线如下:
(1)化合物I的分子式为 。
(2)反应①的化学方程式为 ;反应②的反应类型是加成反应,该反应的另一种反应物的结构简式是 。
(3)化合物IV的结构简式为 。
(4)有关对化合物III、IV、V的说法,正确的是 。
a.能燃烧,产物均是CO2和H2O b.均能与NaOH溶液反应
c.均能发生消去反应 d.均能使溴水因反应而褪色
(5)化合物I有多种同分异构体,其中能发生与FeCI3溶液的显色反应和银镜反应,且苯环上有两种化学环境不同的氢原子的结构简式为 (任写一种)。
过渡金属钯催化的偶联反应是近年来有机合成的热点之一,如反应①:
化合物II可由以下合成路线获得:
(1)化合物I所含官能团的名称为 ,化合物II的分子式为 。
(2)化合物IV的结构简式为 ,某同学设想无需经反应②、③、④和⑤,直接用酸性KMnO4溶液就可将化合物III氧化为化合物VII,该设想明显不合理,其理由是 。
(3)化合物VII有多种同分异构体,请写出一种符合下列要求的结构简式 。
i)苯环上有两个取代基
ii)1 mol 该物质发生银镜反应能生成4 mol Ag
(4)反应⑥的化学方程式为 。(注明条件)
(5)化合物 与化合物
与化合物 在一定条件下按物质的量之比1∶2可发生类似反应①的反应,请写出其产物的结构简式 。
在一定条件下按物质的量之比1∶2可发生类似反应①的反应,请写出其产物的结构简式 。
C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:
(1)写出A的电子式 ;D的最简式 ;
(2)写出碳化钙与水反应制取A的化学方程式 ;苯和液溴反应生成E的化学方程式 ,其反应类型为 。B→C的化学方程式 ,其反应类型为 。
(3)D还可以用石蜡油制取,D在一定条件下存在如下转化关系(石蜡油含17个碳原子以上的液态烷烃,部分反应条件、产物被省略),G是一种酸性物质,H是具有果香气味的烃的衍生物。
a.工业上,由石油获得汽油、煤油、石蜡油等成份的方法是 ;
b.D→F的化学方程式 ,其反应类型是 。
锂电池中Li+迁移需要一种高分子化合物作为介质,合成该高分子化合物的单体(化合物V)的反应如下:
化合物I的合成路线如下:
(1)化合物I的分子式为 ;化合物V中含氧官能团的名称为 。
(2)C4H8呈链状,其结构中有一个碳上没有氢原子,写出由IV→III反应的化学方程式 。
(3)II的一种同分异构体,能发生分子内酯化反生成五元环状化合物,写出该同分异构体的结构简式 ,由II→I的反应类型为 。
(4)苯酚也可与 发生类似反应①的反应,试写出其中一种产物的结构简式 。
发生类似反应①的反应,试写出其中一种产物的结构简式 。
油漆、胶粘剂行业的新型溶剂——碳酸二甲酯(简称DMC)是近年来受到国内外广泛关注的环保型绿色化工产品。其分子结构中含有特别的原子基团 ,无机物H2CO3也可以写成
,无机物H2CO3也可以写成 结构。国内外现有DMC的合成方法很多,如酯交换法:
结构。国内外现有DMC的合成方法很多,如酯交换法: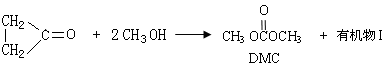
(1)有机物I的结构简式为 ;
(2)DMC参与以下反应①: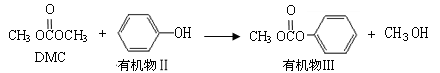
有机物III分子式为 ;
有机物II与过量饱和溴水反应的化学反应方程式为 。
(3)DMC与足量NaOH溶液反应的化学方程式为 (注明条件)。
(4)有机物IV是有机物III的一种同分异构体,且IV具有以下性质特征:
A.是一种芳香族化合物 B.能与FeCl3发生显色反应
C.能发生水解反应,也能发生银镜反应 D.苯环上的一氯代物有两种
则有机物IV的结构简式为 。
(5)以DMC合成杀虫剂西维因的路线如下:
其中生成有机物V的反应类似于反应①,有机物V的结构简式为 。
1mol西维因最多可与 mol H2发生加成反应。
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D原子核外哑铃形原子轨道上有2个未成对电子,D与A形成的化合物分子构型是V型。B元素是形成化合物种类最多的元素,A、B的最外层电子数之和与C的最外层电子数相等,F是同周期第一电离能最小的元素。
(1)写出C元素基态原子的价电子排布式 ;B、C、D三种元素电负性由大到小的顺序为(用元素符号表示) ;
(2)E与A能形成分子式为EA的化合物。接近EA沸点的EA蒸气的相对分子质量测量值要大于其分子计算值,原因是 ;C、D分别与A形成最简单分子中,稳定性较高的是 (填化学式)分子;该分子再与A+结合成离子时,ACA键的键角会 (填“变大”、“不变”或“变小”)
(3)C与F形成的化合物FC3中,C3的空间构型为 ,C3—中心原子采用 杂化。灼烧FC3时,火焰呈现特殊颜色,请从原理上解释产生该现象的原因: 。
(4)右图为B元素的某种单质晶体的晶胞,则该晶体中B原子的空间占有率为 (用r表示B的原子半径,用带r的表达式表示,不必简化)
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
试回答以下问题
(1)B在周期表中的位置是 。B的氢化物与E的氢化物比较,沸点较高的是 (填化学式),在水中溶解度较大的是 (填化学式)
(2)写出D3B与甲反应所得溶液呈 (填“酸性”、“碱性”或“中性”),原因是(用化学方程式表示) 。
(3)写出丙的电子式为 。说明丙的水溶液在放置过程中其酸性会增强的原因(用离子方程式表示) 。
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。可用来鉴别丁和氯化钠的试剂有 。
A.氢碘酸和淀粉的混合液
B.AgNO3溶液
C.甲基橙试剂
D.稀硫酸
(5)将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式 。
高分子G是常用合成材料,可通过下列路线合成。已知F的质谱图中最大质荷比为86,其中C、H、O的原子个数之比为2:3:1,F在酸性条件下水解可生成碳原子数相同的两种有机物D和E。
请回答下列问题:
(1)B的分子式为 ,F分子含氧官能团的名称为 。
(2)G的结构简式为 。
(3)反应①、⑥的反应类型均是 。
(4)反应②的化学方程式为 。
(5)已知: ,则E的结构简式为 。
,则E的结构简式为 。
(6)在F的同分异构体中,核磁共振氢谱有三个峰,三个峰的面积之比为1:1:1,任意写出其中一种满足上述条件的结构简式 。
酰氯(RCOCl或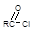 )中的氯原子很活泼,易水解或醇解;例如RCOCl+R’OH → RCOOR’+HCl(R、R’为烃基;可相同,也可不同。)
)中的氯原子很活泼,易水解或醇解;例如RCOCl+R’OH → RCOOR’+HCl(R、R’为烃基;可相同,也可不同。)
甲酯除草醚是大豆种植中常用的除草剂,其合成线路如下所示: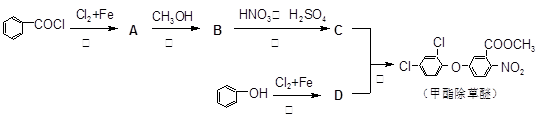
请回答下列问题:
(1)甲酯除草醚分子中官能团的名称是 ;
(2)C和D的结构简式分别是 , ;
(3)反应⑤属于 反应;
(4)写出反应②的化学议程式 ;
(5)A的同分异构体E有下列性质:能够发生银镜反应,核磁共振氢谱有三个波峰。写出E的所有结构简式 。
X、Y、Z、W四种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中Y与Z为同一周期,X与W为同一主族,Z元素的外围电子排布为nsnnp2n,W在空气中燃烧可以得到淡黄色固体。又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。请回答下列问题:
(1)W在元素周期表中的位置是 ;基态时Y的电子排布式是___。
(2)比较元素Y和Z的第一电离能:Y Z(填“大于”、“小于”或“不确定”),将YX3通入溴水中可发生反应,生成Y的单质和一种盐M,Y的单质中的σ键和π键个数比为 ,盐M的晶体类型是 。
(3)由W和Y组成的化合物易水解,其水解的化学方程式是 ;
(4)已知Y2X4和过氧化氢混合可作火箭推进剂。12.8g液态Y2X4与足量过氧化氢反应生成Y的单质和气态水,放出256.65kJ的热量:
2H2O2(l) = O2(g)+2H2O(l) ΔH=-196.4KJ/mol
H2O(l) = H2O(g) ΔH=+44KJ/mol
写出液态Y2X4和氧气反应生成Y的单质和液态X2Z的热化学方程式 。
已知X、Y、Z、M、W、R是前四周期中的六种元素。X元素原子形成的离子是一个质子,Y原子的价电子构型为2s22p2,Z的单质在常温下是无色气体且Z原子的单电子个数是同周期元素原子中最多的。
(1) 24R原子最外层的电子排布图是 ,ZO3-的空间构型是 ;
(2) Z、M、W原子序数依次增大,三种元素的第一电离能由大到小的顺序是 ;Y、Z、W三种元素的电负性由大到小的顺序是 。(填元素符号)
(3) Ne与Wn-的电子数相同,W所在族的各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是 。(填化学式)
(4)ZX4W在物质中,各种粒子间的相互作用力包括 。(填字母编号)
| A.非极性共价键 | B.极性共价键 | C.配位键 | D.离子键 E.氢键 |
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(水及部分产物已略去)。
(1)若X为金属单质,W是某强酸的稀溶液。X与少量W反应生成Z的离子方程式为 ,向Y溶液中加入某种试剂 (填试剂名称),若溶液出现血红色,即可判断Y溶液中阳离子的存在。
(2)若X、Y为正盐,X的水溶液显酸性,W为NaOH溶液,写出Y与X在水溶液中转化为Z的离子反应方程式 。
(3)若X为强碱,常温下W为有刺激性气味的气态氧化物。常温时,将Z的水溶液露置于空气中,溶液的PH变化是 (填“变大”、“变小”、“不变”。不考虑水的挥发),其原因是_________ (用简要的文字说明,并写出离子方程式)。
(4)室温下,若用 的NaOH溶液滴定
的NaOH溶液滴定 mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。