萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α-萜品醇G的路线之一如下:

已知:
请回答下列问题:
(1) 试剂Y的结构简式为________________。
(2) A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式____________。
(3) B的分子式为___________;写出同时满足下列条件的B的链状同分异构体的结构简式:________________。
① 核磁共振氢谱有2个吸收峰 ② 能发生银镜反应
已知: 。为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
。为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:

(1)常温下,下列物质能与A发生反应的有________(填序号)。
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)由A催化加氢生成M的过程中,可能有中间生成物 和____________(写结构简式)生成。
和____________(写结构简式)生成。
(3)检验D中是否含有C可选用的试剂是____________(任写一种名称)。
(4)物质D也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为____________。
(5)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:____________________________。
《茉莉花》是一首脍炙人口的中国民歌,茉莉花香气的成分有多种,乙酸苯甲酯 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
回答下列问题:
(1)A、B的结构简式为______________,______________;
(2)写出反应②、⑥的化学方程式_______________,_______________;
(3)上述反应中属取代反应的有______________;(填写序号)
(4)反应______________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
下图所示各物质是由1~18号部分元素组成的单质或化合物,图中部分反应条件及产物未列出。已知:A、B、H的焰色反应呈黄色;A、C、D、F均为单质,物质G是使湿润的红色石蕊试纸变蓝的气体:J为白色沉淀,既能溶于B,又能溶于E。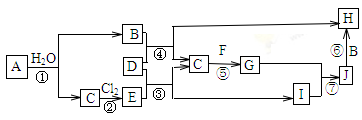
回答下列问题:
(1)写出物质G的一种用途_________________。
(2)①~⑦中属于化合反应的是______________________。
(3)按要求写出下列反应的表达式
物质I的电离方程式为_______________,反应①的离子方程式为_______________________,
反应⑥的化学方程式为______________________。
(4)向I的水溶液中滴加B溶液至过量,观察到的现象为______________________。
中学化学常见的有机化合物A(C6H6O)是重要的化工原料,在工业上能合成紫外线吸收剂BAD和治疗心脏病药物的中间体F,合成路线如下:
已知:BAD的结构简式为:
F的结构简式为:
试回答:
(1)H中含有的官能团名称是_____________。
(2)写出X的结构简式_____________。
(3)写出反应类型A→B_____________;W→BAD_____________。
(4)C→D的过程中可能有另一种产物C1,请写出在加热条件下C1与足量稀NaOH水溶液反应的化学方程式:_____________。
(5)B与HCHO在一定条件下反应生成高分子化合物的原理,与酚醛树脂的制备原理相似。请写出该反应的化学方程式___________________。
(6)W的同分异构体有多种,写出所有符合以下要求的W的同分异构体:
①与FeCl3反应,溶液呈紫色;②能发生银镜反应;③苯环上的一氯代物只有两种。
___________________________。
A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。

请回答下列问题:
(1)A物质的名称为________________;
(2)C与D在高温下的反应在冶金工业上称为 反应,C与D反应的化学方程式: 。
(3)写出G→J的化学方程式:___ ;
写出J→D的化学方程式: ;
(4)A→H的离子方程式为_____________________________;
(5)用离子方程式表示I物质能用于净水的原理___________ _。
下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
中学化学中几种常见物质的转化关系如下图(部分产物未列出)。A是一种生活中常见金属单质之一,D是淡黄色固体单质。
请回答下列问题:
(1)A、G的化学式分别为A________,G________;
(2)用物理方法洗去试管内壁的D,应选择的试剂是_______________;
(3)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是________(填字母);
A.C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4===FeSO4+H2O
(4)写出反应E+H2O2→F的离子反应方程式:______________________________;
(5)写出B→C的离子反应方程式:_______________________________________;
(6)若足量A与少量F在加热条件下反应,得到E和另一种气体,其体积比为1:1,则参加反应的A与F的物质的量之比为_______________。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与 E同周期;E元素原子的最外层电子数是其次外层电子数的 3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)E元素在元素周期表中的位置是_______________。
(2)由A、B、C三种元素形成的离子化合物的化学式为_________________。
(3)A可分别与C、E形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式)_______________。
(4)F含有的化学键类型是___________和_____________,其水溶液呈酸性,请用相关的离子方程式解释其原因___________。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为______。
已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
| 元素 |
结构或性质信息 |
| T |
原子的L层上s电子数等于p电子数. |
| X |
元素的原子半径是第三周期主族元素中最大的. |
| Y |
空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z |
单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
下图是元素周期表的一部分
(1)元素⑩的次外层电子数为__________个。
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是___________________;
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式____________________;
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一主族的是_________.(填元素代号)
②T元素最可能是________(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为____________。
A、B、C、D、E 五种物质存在以下转化关系,已知A 为金属单质,在以下各步反应中E 是白色沉淀。
(1)试确定各物质的化学式:
A ________________B __________C__________ D________________ E____________
(2)写出以下反应的离子方程式:
A →C _________________________________
B →E _________________________________
[化学——有机化学基础]
没食子酸丙酯简称PG,结构简式为 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
(1)PG的分子式为_________,请写出PG分子中所含官能团的名称______________,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是___________;
PG可发生如下转化:

(2)A的结构简式为_______________,1mol没食子酸最多可与_______mol H2加成;
(3)上图的有关变化中,属于氧化反应的有(填序号)____________;
(4)从分子结构或性质上看,PG具有抗氧化作用的主要原因是(填序号)____________;
a.含有苯环 b.含有羧基 c.含有酚羟基 d.微溶于食用油
(5)反应④的化学方程式为_______________;
(6)B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式_______________;
i.含有苯环,且苯环上的一溴代物只有一种;
ii.既能发生银镜反应,又能发生水解反应。
【化学—选修3:物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2﹣和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为 ;
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ,A和B 的氢化物所属的晶体类型分别为 和 ;
(3)C和D反应可生成组成比为1︰3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 ;
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a =" 0.566" nm,F的化学式为 ,列式计算晶体F的密度(g.cm-3) 。
