(15分)某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02。某工厂利用此矿石炼制精铜的工艺流程示意图如下: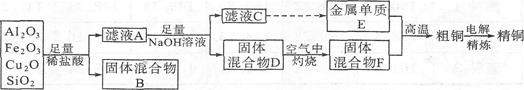
已知:CuO2+2H+=Cu+Cu2++H2O
(1)滤液A中铁元素的存在形式为 (填离子符号),生成该离子的离子方程式为 ,检验滤液A中存在该离子的试剂为 (填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为 。
(3)常温下.等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH一)前者为后者的108倍,则两种溶液的pH= 。
(4)将Na2CO3溶液滴入到一定量的CuCl2溶液中,除得到蓝色沉淀,还有无色无味气体放出,写出相应的离子方程式: 。
(5)①粗铜的电解精炼如图所示。在粗铜的电解精炼过程中,c为粗铜板,则a端应连接电源的 (填“正”或“负”)极,若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有 、 。
②可用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是 、滴定中发生反应的离子方程式为 , 滴定时.锥形瓶中的溶液接触空气,则测得铁元素的含量会 (填“偏高”或“偏低”)。
(原创)三聚氰胺(化学式:C3N6H6)是一种重要有机化工原料。下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺——“常压气相一步法联产纯碱新技术”: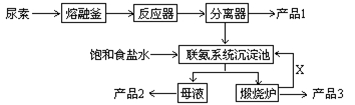
已知:以尿素为原料生产三聚氰胺的原理是:6 CO(NH2)2 C3N6H6 +6 NH3+3CO2
C3N6H6 +6 NH3+3CO2
请回答:
(1)尿素的结构式为
(2)已知:产品1是本工艺的主产品,产品2是副产品,X为循环使用的物质,产品3为纯碱。写出各主要成份的化学式:产品1 产品2 X
(3)联氨系统沉淀池中发生的化学反应方程式为:
(4)为了使母液中析出更多的产品2 ,常用的方法是
| A.加入固体NaCl | B.加入固体NaHCO3 |
| C.通入CO2气体 | D.通入NH3 |
(5)若生产过程中有4%的尿素损耗,每吨尿素理论上可得副产品纯碱 吨(精确到0.001)
CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
已知涉及的部分离子方程式如下:
步骤a:2 MnO4-+5C2O42-+16H+= 2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中
c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2;同时生成Mn2+。该反应的离子方程式为 ;若无该操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。
【化学—化学与技术】选考海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、 池和结晶池。
②工业上通常以NaCl 、CO2和 NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式 。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
Ⅰ.电渗析法淡化海水中阴极室可获得的重要化工原料有 。
II.上图中虚线部分表示 离子交换膜。 淡水从 (A或B)排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
Ⅰ.写出反应③的离子方程式为 。
II.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液? 。
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式 。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如图所示。电解时阳极区会产生气体,产生气体的原因是 。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应是 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
(3)氢化亚铜是一种红色固体,可由硫酸铜为原理制备
4CuSO4 + 3H3PO2 + 6H2O="4CuH↓" + 4H2SO4 + 3H3PO4。
①该反应中还原剂是 (写化学式)。
②该反应每生成1molCuH,转移的电子物质的量为 。
(4)硫酸铜晶体常用来制取波尔多液,加热时可以制备无水硫酸铜。将25.0 g胆矾晶体放在坩埚中加热测定晶体中结晶水的含量,固体质量随温度的升高而变化的曲线如下图。
请分析上图,填写下列空白:
①30℃~110℃间所得固体的化学式是 ,
②650℃~1000℃间所得固体的化学式是 。
煤粉中的氮元素在使用过程中的转化关系如下图所示:
(1)②中NH3参与反应的化学方程式为 。
(2)③中加入的物质可以是 (填字母序号)。
a.空气 b.CO c.KNO3 d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶( ),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
(4)已知:N2(g) + O2(g) 2NO(g) ΔH =" a" kJ·mol-1
2NO(g) ΔH =" a" kJ·mol-1
N2(g) + 3H2(g) 2NH3(g) ΔH =" b" kJ·mol-1
2NH3(g) ΔH =" b" kJ·mol-1
2H2(g) + O2(g) 2H2O(l) ΔH =" c" kJ·mol-1
2H2O(l) ΔH =" c" kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为 。
(5)用间接电化学法除去NO的过程,如下图所示:
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式: 。
用离子方程式表示吸收池中除去NO的原理: 。
(I)在甲溶液中通入过量CO2生成乙和另一种具有漂白性的物质,在乙溶液中滴加某钠盐溶液丙可以生成丁溶液(丁溶液呈中性),同时产生无色无味气体。已知:题中所涉及物质皆为中学化学中常见物质。回答下列问题:
(1)甲的化学式为 。
(2)写出乙在医疗上的一个用途 。
(3)在乙溶液中滴加丙溶液生成丁溶液的离子方程式为 。
(Ⅱ)固体化合物X由四种常见的短周期元素组成,可用作牙膏中的添加剂。现取39.3g化合物X进行如下实验:
实验结束后得到15.3g固体2和6.0g固体3,且固体1、固体2、固体3都可用作耐高温材料。回答下列问题:
(1)NaOH的电子式为 ,沉淀2的化学式为 。
(2)固体X的化学式为 。
(3)溶液1中加入足量NaOH溶液反应的离子方程式为 。
(4)在高温下,固体3中某元素的单质可以与固体1发生置换反应,请写出此反应的化学方程式 。
(5)设计一个实验方案比较固体2和固体3中两种不同元素对应单质的活泼性强弱 。
(共16分)Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:

①燃料电池即电源的N极的电极反应式为 _______________________ ;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)  N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂
C.减小CO2的量 D.扩大容器体积
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置_______________________。
(2)这五种元素原子半径从大到小的顺序为 (填元素符号)。
(3)元素的非金属性Z______Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有______(填序号)。
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的氢化物反应的化学方程式为__________________________________。
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式_______________;B的水溶液不呈中性的原因____________________________(用离子方程式表示)。
(6)液态A类似X2Z,也能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为 。
(7)若使A按下列途径完全转化为F:
①F的化学式为_________;
②参加反应的A与整个过程中消耗D的物质的量之比为_________。
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)“镁-次氯酸盐”燃料电池的装置如下图所示: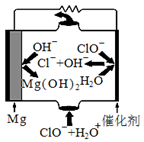
该电池的正极反应式为 。
(2)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g) MgH2(s) △H1=-74.5kJ·mol-1
MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)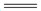 Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s)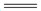 2Mg(s)+Mg2NiH4(s)的△H3= 。
2Mg(s)+Mg2NiH4(s)的△H3= 。
(3)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下: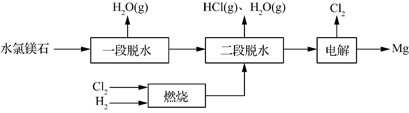
①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。
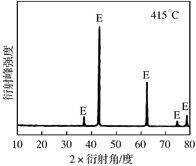
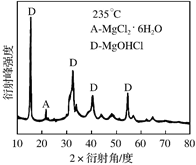
测得E中Mg元素质量分数为60.0%,则E的化学式为 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 。
(4)储氢材料Mg(AlH4)2在110~200°C的反应为:Mg(AlH4)2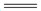 MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
工业制硫酸生产流程如下图: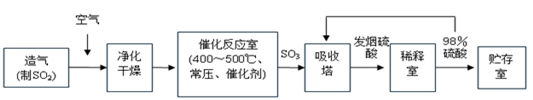
已知:在450℃,常压下,2SO2(g)+O2(g)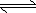 2SO3(g),ΔH=-196 kJ·mol-1。请回答:
2SO3(g),ΔH=-196 kJ·mol-1。请回答:
(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 ;
A.升高温度 B.减少压强 C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率可采取的措施为 ;
A.净化气体 B.控制温度在400~500℃
C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”、“>”或“=”)196kJ。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下,现有100L原料气参加反应,达到平衡时,气体的总体积变为97.2L,则SO2的转化率为 。
(1 6分)钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、
Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下: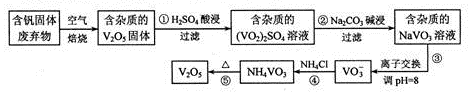
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为
(4)250C、101 kPa时,
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。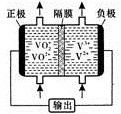
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2 VO2++ H2C2O4+2 H+="2" VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(V02)2S04溶液中钒的含量为 g/L。
(15分)四川省钙芒硝矿(主要成分CaSO4•Na2SO4)资源丰富。钙芒硝矿可生产具有广泛用途的芒硝(Na2SO4•10H2O)和元明粉(Na2SO4),其简要生产流程如下图所示。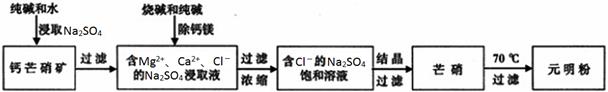
请回答下列问题:
(1)浸取Na2SO4时,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,破坏钙芒硝矿结构,从而促进Na2SO4的浸取。CaSO4能转化为CaCO3的原因是_________________________。
(2)向Na2SO4的浸取液中加入适量烧碱和纯碱,Ca2+和Mg2+分别生成①________、②_________(填化学式)被过滤除去。
(3)根据下图溶解度曲线,可采用冷却结晶法从含少量NaCl的Na2SO4饱和溶液中制得芒硝的原因是___________________________________________________________________________。
(4)已知:25℃、101kPa时,
2C(s) + O2(g) ="=" 2CO(g) ΔH1 = —222kJ/mol
4Na2SO3(s) ="=" 3Na2SO4(s) + Na2S(s) ΔH2 = —122kJ/mol
2Na2SO3(s) + O2(g) ="=" 2Na2SO4(s) ΔH 3= —572kJ/mol
元明粉经碳还原制备Na2S的热化学方程式是__________________________________________________。
(5)如图,用惰性电极电解Na2SO4溶液,阳极区制得H2SO4溶液,阴极区制得NaOH溶液。其电解总反应的化学方程式是:______________________________。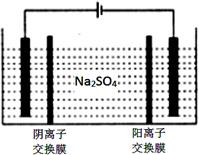
(6)芒硝加热至70℃时,得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4。若3220kg芒硝加热至70℃时,可析出元明粉(Na2SO4)的质量是________kg。
(本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23、三氟化溴(BrF3)常用于核燃料生产和后处理,遇水立即发生如下反应:3BrF3 +5H2O → HBrO3 + Br2 + 9HF+ O2 。该反应中氧化剂与还原剂的物质的量之比为 ,每生成2.24 LO2(标准状况)转移电子数为 。
24、在食盐中添加少量碘酸钾可预防缺碘。为了检验食盐中的碘酸钾,可加入醋酸和淀粉-碘化钾溶液。看到的现象是 ,相应的离子方程式是 。
氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)  Cl2(aq) ---------------①
Cl2(aq) ---------------①
Cl2(aq)+ H2O  HClO + H+ +Cl------②
HClO + H+ +Cl------②
HClO  H+ + ClO- ---------------③
H+ + ClO- ---------------③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
25、写出上述体系中属于电离平衡的平衡常数表达式:Ki = ,由图可知该常数值为 。
26、在该体系中c(HClO) + c(ClO-) c(H+)-c(OH-)(填“大于”“小于”或“等于”)。
27、用氯处理饮用水时,夏季的杀菌效果比冬季 (填“好”或“差”),请用勒夏特列原理解释 。
近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。

则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1) 处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ·mol-1
CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ·mol-1
CH4(g) + 2NO2 (g) = N2(g) + CO2(g) + 2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=______(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。

①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=_________________。