卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
①BrO3- + 6I- + 6H+ = 3I2+ Br-+ 3H2O
② 2BrO3- + I2= 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2+ 3H2O
④ 2IO3- + 10Br-+ 12H+ = I2+ 5Br2+ 6H2O
实验如下:
| 步骤 |
现象 |
| ⅰ. 向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 |
随着KBrO3溶液的滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ. 继续向上述溶液中滴入KBrO3溶液 |
溶液的蓝色逐渐褪去 |
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol e-,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。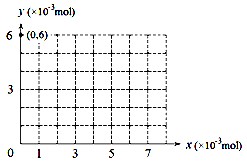
选择适宜的材料和试剂设计一个原电池,以便完成下列反应: 2FeCl3+Cu 2FeCl2+CuCl2。画出原电池的示意图并写出电极反应。
2FeCl2+CuCl2。画出原电池的示意图并写出电极反应。
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点。“碳一化学”即以单质碳及CO、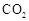 、
、 、
、 等含一个碳原子的物质为原料合成工业产品的化学与工艺。
等含一个碳原子的物质为原料合成工业产品的化学与工艺。
(1)将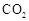 转化成有机物可有效实现碳循环。
转化成有机物可有效实现碳循环。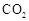 转化成有机物的例子很多,如:
转化成有机物的例子很多,如:
a. b.
b.
c. d.
d.
在以上属于人工转化的反应中,原子利用率最高的是 (填序号)。
(2)CO可用于合成甲醇。在压强0.1MPa条件下,在体积为bL的密闭容器中充入 和
和 ,在催化剂作用下合成甲醇:
,在催化剂作用下合成甲醇:

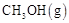 。平衡时CO的转化率与温度、压强的关系如图。
。平衡时CO的转化率与温度、压强的关系如图。
①该反应属于 反应(填“吸热”或“放热”)。若一个可逆反应的平衡常数 值很大,对此反应的说法正确的是 (填序号)。
值很大,对此反应的说法正确的是 (填序号)。
a.反应使用催化剂意义不大
b.该反应发生将在很短时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
②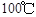 时,该反应的平衡常数
时,该反应的平衡常数 (用
(用 的代数式表示)。
的代数式表示)。
(3)二甲醚( )被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
①工业上利用水煤气合成二甲醚的三步反应如下:
a.

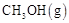

b.



c.



总反应: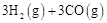

 的
的 。
。
②对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是 (填字母)。
a.
b.容器内压强保持不变
c. 的浓度保持不变
的浓度保持不变
d. 的消耗速率与
的消耗速率与 的消耗速率之比为
的消耗速率之比为
(4)以KOH溶液为电解质,用二甲醚-空气组成燃料,其中负极的电极反应式为 。
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、 等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NO
等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NO )在有催化剂的条件下反应的化学方程式
)在有催化剂的条件下反应的化学方程式
。
试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中;
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中;
(3)分别用等体积的蒸馏水和0.010 mol·L-1硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量。
【物质结构与性质】
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种;写出Cu+的核外电子排布式________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有________种,属于d区的元素有________种。
(3)CaO晶胞如所示,CaO晶体中Ca2+的配位数为 ;CaO的焰色反应为砖红色,许多金属或它们的化
合物都可以发生焰色反应,其原因是_______。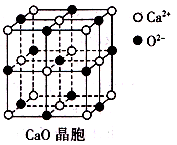
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是_______(填选项字母)。
A NaN3与KN3结构类似,前者晶格能较小
B晶体钾的晶胞结构如图所示: ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子
C氮的第一电离能大于氧
D氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为_______,CNO-的中心原子的杂化方式为______。
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+ (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]X++ xR- Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
(1)下列四种烃分别在氧气中完全燃烧:(填字母序号)
①若烃的物质的量相等,则消耗氧气最多的是 ;
②若烃的质量相等,则消耗氧气最多的是 ;
③若反应前后(150℃)气体的物质的量不发生变化,则该烃可能是 。
A.C2H6 B.C2H4 C.C4H10 D.C5H10
(2)下列各组化合物中,不论二者以什么比例混合,完全燃烧时:
①若总质量不变,耗O2量不变的是 ;生成水的质量不变的是 。
②若总的物质的量不变,则耗O2量不变的是 ;生成CO2的质量不变的是 。
A. C2H4、C3H6 B. HCHO、CH3COOH
C. CH4、CH3COOH D. CH2==CH2、CH3CH2OH
I.已知:C(s)+H2O(g) CO(g)+H2(g) ΔH
CO(g)+H2(g) ΔH
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100 kPa |
4.56 |
5.14 |
5.87 |
6.30 |
7.24 |
8.16 |
8.18 |
8.20 |
8.20 |
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变 B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变 D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s) ΔH=ax kJ/mol ①
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s) ΔH=bx kJ/mol。 ②
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是 。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。试分析: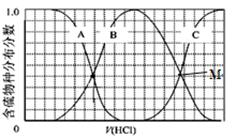
①B曲线代表 分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)= 。
②M点,溶液中主要涉及的离子方程式 。
我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为 ;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为 。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式 。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费, 为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程: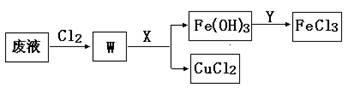
①试剂Y的名称 ;物质X最好是 (填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol· , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)。
W (s) + 3H2O (g)。
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___________________________。
(2) 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为___________;随温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
(3)用H2还原WO2也可得到金属钨。已知:
WO2 (s) + 2H2 (g) W (s) + 2H2O (g) ΔH =" +66.0" kJ·mol-1
W (s) + 2H2O (g) ΔH =" +66.0" kJ·mol-1
WO2 (g) + 2H2 (g) W (s) + 2H2O (g) ΔH =" -137.9" kJ·mol-1
W (s) + 2H2O (g) ΔH =" -137.9" kJ·mol-1
则WO2 (s) WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) 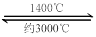 WI4 (g)。下列说法正确的有________________(填序号)。
WI4 (g)。下列说法正确的有________________(填序号)。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
(本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: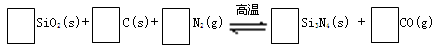
29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是 ,其还原产物是 。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。
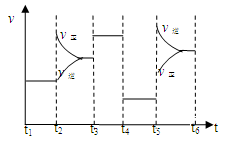
32.该反应的平衡常数表达式为K= 。升高温度,其平衡常数 (选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是
,t3引起变化的因素为 ,t5时引起v逆大变化、v正小变化的原因是 。
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素D在周期表中的位置是 。
(2)该配位化合物的化学式为 。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 。
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61×10-8cm,则E的密度为 ;EDC4常作电镀液,其中DC 的空间构型是 ,其中D原子的杂化轨道类型是 。
的空间构型是 ,其中D原子的杂化轨道类型是 。
Ⅰ.硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下: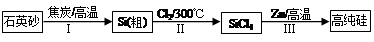
(1)焦炭在过程Ⅰ中做 剂。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的化学方程式为 。
(3)整过生产过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应方程式为 。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是 。
(4)Zn还原SiCl4的反应如下:
反应①:400℃~756℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(l) △H1<0
Si(S)+2ZnCl2(l) △H1<0
反应②:756℃~907℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(g) △H2<0
Si(S)+2ZnCl2(g) △H2<0
反应③:907℃~1410℃,SiCl4(g)+2Zn(g) Si(S)+2ZnCl2(g) △H3<0
Si(S)+2ZnCl2(g) △H3<0
i. 反应②的平衡常数表达式为 。
ii. 对于上述三个反应,下列说明合理的是 。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应速率 d.Na、Mg可以代替Zn还原SiCl4
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,可用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化成H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程 。
Ⅱ.(1)甲烷、氢气、一氧化碳的燃烧热分别为akJ·mol-1,bkJ·mol-1,ckJ·mol-1,工业上利用天燃气和二氧化碳反应制备合成气(CO、H2),其热化学反应方程式为 。
(2)已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,三种难溶盐的饱和溶液中,Ag+浓度大小的顺序为 。
化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体.被称之为“未来能源”。在25℃、101 kPa下,1g甲烷完全燃烧生成和液态水时放热55.6 kJ。甲烷燃烧的热化学方程式为 ______:相同条件下,356 g可燃冰(分子式为CH4·9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_______kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制各二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)═CH3OH(g) △H1=-90.1kJ•mol-1
(Ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g) △H2=-49.0kJ•mol-1
水煤气变换反应:(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2 (g) △H3=-41.1kJ•mol-1
二甲醚合成反应:(Ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ•mol-1
①分析二甲醚合成反应(iv)对于CO转化率的影响___________________________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:__________________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响_________________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为______________________,一个二甲醚分子经过电化学氧化,可以产生________电子的电量。
(12分)根据下列某些短周期元素中元素性质回答问题。
| |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
| 原子半径/10 -10m |
0.37 |
1.86 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.52 |
0.75 |
0.71 |
| 最高价态 |
+1 |
+1 |
|
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
|
| 最低价态 |
-1 |
|
-2 |
|
-4 |
-3 |
-1 |
|
-3 |
-1 |
(1)元素③、⑥和⑨的氢化物中沸点由高到低的顺序是__________ (填化学式)。
(2)元素①和⑨形成阳离子 ,其结构式为__________________。
(3)某元素R的原子半径为1.02×10 -10m ,它与钠形成Na2R2,其电子式是_________(R用元素符号表示)。
(4)元素②和⑦形成晶体的部分结构可用下图中的_________来表示(填序号)。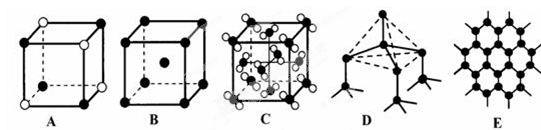
(5)①、③、⑨可以形成原子个数之比为4:3:2的中学常见无机化合物,该化合的水溶液显酸性的原因是_________________(用离子方程式表示),其水溶液中离子浓度由大到小的顺序是___________________。
在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数Kw= 。
(2)该温度下,将100mL 0.1mol/L的稀硫酸与100mL 0.4mol/L的NaOH溶液混合后,溶液的pH= ,此时该溶液中由水电离的c(OH-)= mol/L。
(3)该温度下,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前该强酸的pH1与强碱的pH2应满足的关系是 。
(4)该温度下,pH=3的硫酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7);pH=3的醋酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7)。