某同学查阅资料后设计了一条1-丁醇的合成路线:
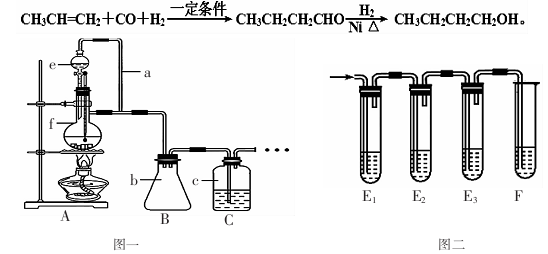
(1)利用图一装置可制备CO、丙烯等原料气体。①装置中e的名称是 ;
②a的作用 ;
(2)实验室常用浓硫酸与甲酸作用来制备CO。写出对应的化学方程式: 。
(3)制CO时,伴随的副产物还有少量S02、C02气体,某同学设计用图二装置进行检验。
①E1的作用是: ;E3的作用是: ;
②判断产物中有CO2的现象是
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
| A.高温、常压、催化剂 | B.适当的温度、常压、催化剂 |
| C.低温、高压、催化剂 | D.适当的温度、高压、催化剂 |
(5)正丁醛经催化加氢得到含少量正丁醛的1一丁醇粗品,为提纯1-丁醇,该小组查阅文献得知:①R-CHO+NaHS03(饱和)→RCH(OH)S03Na ↓;②沸点:乙醚34℃,1-丁醇118℃。并设计出如下提纯路线:
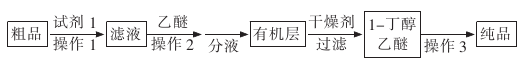
试剂1为 ,操作2为 ,操作3为
(一)如图所示,甲、乙是电化学实验装置,请回答下列问题:

若甲、乙两个烧杯中均盛放饱和NaCl溶液。
①甲中石墨棒上的电极反应式是_________________________________
②乙中总反应的离子方程式为___________________________________
③若乙中含有0.10 mol·L-1NaCl溶液400mL,当阳极产生的气体为560mL(标准状况下)时,溶液的pH=_____________(假设溶液体积变化忽略不计),转移电子的个数为____________
(二)肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景。其工作原理如上图所示,回答下列问题:
①该燃料电池中正极通入的物质是__________;
负极发生的反应式为:__________________________
②电池工作时,OH- 移向极________(“a”或“b”)
③当电池放电转移5mol电子时,至少消耗燃料肼________g
(三)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42﹣.电池放电时,负极的电极反应为:V2+﹣e﹣=V3+.
①电池放电时的总反应方程式为___________________________
充电时,电极M应接电源的_________ 极
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前 需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+.则第一步反应过程中阴极区溶液n(H+)__________(填“增大”、“不变”或“减小”) ,阳极的电极反应式为_________________________
化学是一门以实验为基础的学科。
(1)下列实验操作的描述中,正确的是________(填序号)
①为使稀硫酸和锌制取氢气的反应速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒
②粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌漏斗中的液体
③配制一定物质的量浓度的溶液时,容量瓶洗涤后不用进行干燥
④蒸馏操作中,温度计水银球部位要插入液面下且不接触蒸馏烧瓶壁
⑤可以在试管中加热氯化铵固体制备少量氨气
⑥盛放石灰水的试剂瓶内壁常有一层白色固体物质,可用稀硫酸清洗除去
(2)下列叙述中正确的是 (填序号).
| A.分液漏斗、滴定管和容量瓶使用前必须检查是否漏水 |
| B.将碘水倒入分液漏斗,再加适量乙醇,充分振荡、静置,可从碘水中萃取碘 |
| C.洁净的铁钉在食盐水中浸泡一段时间,铁钉上有气泡,说明铁发生了析氢腐蚀 |
| D.铁丝在氯气中剧烈燃烧,火星四射,生成黑色固体 |
E.酸碱中和滴定实验中,锥形瓶用蒸馏水洗净后直接使用,而滴定管用蒸馏水洗净后,必须润洗后使用
(3)用铜片与稀硝酸反应制取NO气体,如图装置中适合的是 (填图甲或图乙);装置B中的试剂最好是 ,该装置的作用是

有一混合物的水溶液,只可能含以下离子中的若干种:K+ 、Al3+ 、Fe3+ 、Mg2+ 、Ba2+ 、 NH4+、Cl- 、CO32-、SO42 -,现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加过量NaOH溶液加热后收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
③在甲溶液中通过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
④第三份加足量BaCl2溶液后得白色沉淀,沉淀经足量盐酸洗涤干燥后质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是___________,不能确定是否存在的离子是_____________。
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):
离子符号______,浓度__________________;
离子符号______,浓度__________________;
(3)试确定K+ 是否存在________(填“是”或“否”),判断的理由是__________。
为验证卤素单质氧化性的相对强弱,某小组同学用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)氯、溴、碘单质的氧化性逐渐减弱的原因:从原子结构分析,同主族元素从上到下 ,得电子能力逐渐减弱。
(5)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是___________ ___。
实验室以苯、乙醛为原料,AlCl3为催化剂制备1,1–二苯乙烷,其反应原理为:

已知:AlCl3固体遇水会发生较强烈水解。
I.制取装置如右图所示。
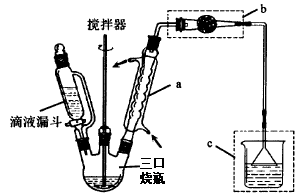
(1)该反应需控制反应温度为20℃。控制20℃的方法是 ;该反应不高于20℃的可能原因是: 。
(2)仪器a的作用是 ;装置c的作用是吸收HCl,写出产生HCl的化学方程式 ;装置b的作用是 。
Ⅱ.实验结束后,将三口烧瓶中的混合物倒入冷稀盐酸中,用分液漏斗分离出有机层,依次用水、2%碳酸钠溶液、水洗涤,洗涤后加入少量无水硫酸镁固体,过滤、蒸馏,得到1,1–二苯乙烷。
(1)分液漏斗中,产品在 (填“上”或“下”)层;洗涤操作中,第二次水洗的目的是 ;无水硫酸镁也可用物质 代替。
(2)蒸馏提纯时,下列装置中会导致收集到的产品中混有低沸点杂质的装置是 (选填编号)。

(3)三口烧瓶中加入120mL苯(密度0.88g/mL)、19g A1C13和3.7g乙醛,20℃时充分反应,制得纯净的1,1–二苯乙烷7.8g。该实验的产率约为 。
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu元素的相对原子质量,同时检验氯气的氧化性。

(1)为完成上述实验,正确的连接顺序为A连 ;B连 (填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为 。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是 ,对应的现象为 。
(4)丙装置的c瓶中盛放的试剂为 ,作用是 。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案,精确测量硬质玻璃管的质量为a g, 放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g ,充分反应完全后。
甲方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
乙方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g, 进而确定Cu的相对原子质量。
①请你分析并回答: 方案测得结果更准确。你认为不合理的方案的不足之处在 。
②按测得结果更准确的方案进行计算,Cu的相对原子质量是 。
过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出实验装置(如图):

(1)请写出过氧化钠与水反应的离子方程式 ;
(2)A中为制取CO2的装置,写出有关反应的离子方程 ;
(3)B装置发生反应的化学方程式 ;
(4)若E中石灰水出现轻微白色浑浊,请说明原因: ;
(5)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值_________(填大或小),相差约 mL(取整数值,所用数据均在标准状况下测定),这可能是由于 (写出一个原因即可)。
取6根铁钉,6支干净的试管及其他材料,如图所示。
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是____ (填试管序号);在电化学腐蚀中,负极反应是__________。
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是___________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是_______(答两种方法)。
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧;烧碱和纯碱溶液均显碱性。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
【提出假设】假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:__________________________(请你写出)。
【设计实验方案、验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
|
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是________________。
(2)通过方案1和方案2的实验,你认为上述三个假设中,________成立。你的理由是______。
(3)钠在二氧化碳中燃烧的化学方程式为____________________。
(4)乙同学认为白色物质有可能是氢氧化钠.你是否同意乙同学的观点,并简述理由:_______。
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:

(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式 _____;装置C的作用是 。
(3)E处石蕊试液的现象是_______________;
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成 B.无白色沉淀生成 C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是________________,B的作用是________________。
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,混合溶液中由水电离出的c(H+)_______0.2mol/LHCl溶液中由水电离出的c(H+)(填“>”、“<”、或“=”) 。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_____________。(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 |
0.1032mol/L HCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
25.00 |
| 2 |
26.53 |
25.00 |
| 3 |
27.85 |
25.00 |
①待测NaOH溶液的物质的量浓度为________________mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是____________。
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
1.8×10﹣10 |
5.0×10﹣13 |
8.3×10﹣17 |
2.0×10﹣48 |
1.8×10﹣10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的_________________。
A.KBr B.KI C.K2S D.K2CrO4
现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤
(1)用________(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到
100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
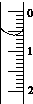
(3)读取盛装0.100 0 mol/L NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为_______mL。
(4)滴定。当____________________________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
| 滴定次数实验数据(mL) |
1 |
2 |
3 |
4 |
| V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积
V=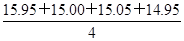 mL=15.24 mL
mL=15.24 mL
指出他的计算的不合理之处:______________________________________
按正确数据处理,可得c(市售白醋)=________mol/L;市售白醋总酸量________g/100 mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为: 。
(2)装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 。
| |
A |
B |
C |
D |
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是 。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 。
(5)某同学建议将装置F中的药品改用足量的NaHSO3溶液吸收余氯,老师认为不妥,用总反应的离子方程式解释原因 。
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是_______ 。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是___________ ;仪器c的名称是 ,其作用是___________ 。反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是_________ 。下列仪器中可用于分离苯乙酸粗品的是______ (填标号)。
A 分液漏斗 B 漏斗 C 烧杯 D 直形冷凝管 E 玻璃棒
(3)提纯粗苯乙酸的方法是________________ ,最终得到44 g纯品,则苯乙酸的产率是_________ 。
(4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是______________ 。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是_____________________ 。