配制500mL 0.5mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为 。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将 (填“高于”或“低于”)右边的托盘。
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线1cm~2cm。
③将NaOH溶液沿玻璃棒注入500mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上顺序编出正确程序 。
A、①③②④⑤ B、①④③②⑤ C、①③④②⑤ D、①④②③⑤
(4)某学生实际配制NaOH溶液的浓度为0.48mol·L-1,不可能的原因是
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.转移溶液后的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢
化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。

①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒,当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 E.双氧水 F.硝酸银 |
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液由 ;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 ;
(3)该小组在步骤①中的错误是 ,由此造成的测定结果___________ (填偏高、偏低或无影响)
(4)步骤②缺少的操作是_______ ___ _
(5)右图,是某次滴定时的滴定管中的液面,其读数为___________mL;(上面数字:22,下面数字:23)。
实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为
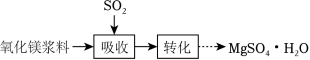
(1)在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成 ,反应为 ,其平衡常数 与 的代数关系式为 __________;下列实验操作一定能提高氧化镁浆料吸收 效率的有_____(填序号)。
| A. |
水浴加热氧化镁浆料 |
| B. |
加快搅拌速率 |
| C. |
降低通入 气体的速率 |
| D. |
通过多孔球泡向氧化镁浆料中通 |
(2)在催化剂作用下 被 氧化为 。已知 的溶解度为 , 氧化溶液中 的离子方程式为__________;在其他条件相同时,以负载钴的分子筛为催化剂,浆料中 被 氧化的速率随 的变化如题图甲所示。在 范围内,pH增大,浆料中 的氧化速率增大,其主要原因是__________。
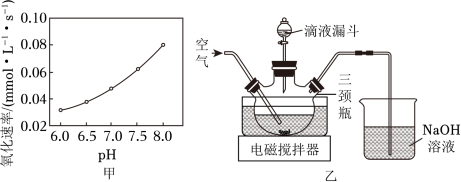
(3)制取 晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的 浆料与 溶液充分反应。 浆料与 溶液的加料方式是__________;补充完整制取 晶体的实验方案:向含有少量 的 溶液中,_______________。(已知: 在 时完全转化为氢氧化物沉淀;室温下从 饱和溶液中结晶出 , 在 下干燥得到 ,实验中需要使用 粉末)
超纯 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如图:

知:①金属 的化学性质和 相似, 的熔点为 ;
② (乙醚)和 (三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
|
|
|
|
回答下列问题:
(1)晶体 的晶体类型是_____;
(2)“电解精炼”装置如图所示,电解池温度控制在 的原因是__________,阴极的电极反应式为_____;

(3)“合成 ”工序中的产物还包括 和 ,写出该反应的化学方程式_______________;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_____;
(5)下列说法错误的是_____;
A.流程中 得到了循环利用
B.流程中,“合成 ”至“工序 ”需在无水无氧的条件下进行
C.“工序 ”的作用是解配 ,并蒸出
D.用核磁共振氢谱不能区分 和
(6)直接分解 不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯 的理由是 ____________________;
(7)比较分子中的 键角大小: _____ (填“>”“<”或“=”),其原因是__________。
钴配合物[Co(NH3)6]Cl3溶于热水,在冷水中微溶,可通过如下反应制备:2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O
2[Co(NH3)6]Cl3+2H2O
具体步骤如下:
Ⅰ.称取2.0gNH4Cl,用5mL水溶解。
Ⅱ.分批加入3.0gCoCl2•6H2O后,将溶液温度降至10℃以下,加入1g活性炭、7mL浓氨水,搅拌下逐滴加入10mL6%的双氧水。
Ⅲ.加热至55~60℃反应20min。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的25mL沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入4mL浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如图。

仪器a的名称是 。加快NH4Cl溶解的操作有 。
(2)步骤Ⅱ中,将温度降至10℃以下以避免 、 ;可选用 降低溶液温度。
(3)指出下列过滤操作中不规范之处: 。

(4)步骤Ⅳ中,趁热过滤,除掉的不溶物主要为 。
(5)步骤Ⅴ中加入浓盐酸的目的是 。
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为: 。下图为刚性容器中,进料浓度比 c(HCl) ∶ 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
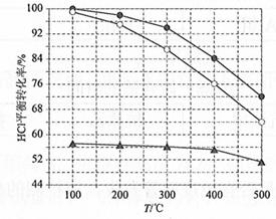
可知反应平衡常数 K(300℃)________ K(400℃)(填"大于"或"小于")。设HCl初始浓度为 , 根据进料浓度比 c(HCl)∶ c(O 2)=1∶1的数据计算 K(400℃)=________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 c(HCl)∶ 过低、过高的不利影响分别是________。
(2)Deacon直接氧化法可按下列催化过程进行:
Δ
Δ
Δ
则 的 Δ H=________ 。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
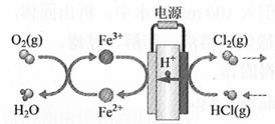
负极区发生的反应有________(写反应方程式)。电路中转移1 mol电子,需消耗氧气________L(标准状况)
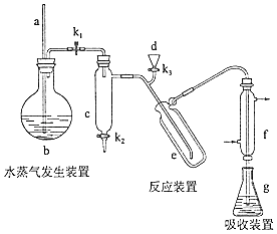
凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知: .
回答下列问题:
(1)a的作用是________.
(2)b中放入少量碎瓷片的目的是________.f的名称是________.
(3)清洗仪器:g中加蒸馏水:打开 , 关闭 、 , 加热b,蒸气充满管路:停止加热,关闭 , g中蒸馏水倒吸进入c,原因是________;打开 放掉水,重复操作2~3次.
(4)仪器清洗后,g中加入硼酸( )和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭 , d中保留少量水,打开 , 加热b,使水蒸气进入e.
①d中保留少量水的目的是________.
②e中主要反应的离子方程式为________,e采用中空双层玻璃瓶的作用是________.
(5)取某甘氨酸( )样品m 克进行测定,滴定g中吸收液时消耗浓度为 的盐酸 ,则样品中氮的质量分数为________%,样品的纯度≤________%.
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置:
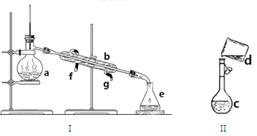
(1)写出下列仪器的名称:A. B. C.___________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水的进出方向为 。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和托盘天平外,为完成实验还需的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)______________.
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为_____________,____________;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)______________.
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体应是(填化学式)____________.
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为_____________,请设计实验检验所得溶液中溶质的阴离子______________.
实验题

I.(1)写出上图中A仪器的名称___________(2)冷凝管的进水口为_____________(填字母)
Ⅱ.实验室要配制2 mol/L稀硫酸240 mL。
(1)量取浓硫酸时,用下面那种规格的量筒____________(填序号)
①10 ml ②50 ml ③100 ml ④500 ml
(2)配制该稀硫酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有 、 、 等.
(3)在配制过程中,如果出现下列情况,将对所配溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸时,仰视量筒进行读数_____________;
②定容时,液面超过刻度线后用胶头滴管吸至液面处_____________;
③ 容量瓶事先有水,没干燥_____________
III.200ml 5mol/lNaOH溶液中含溶质的质量是 g,取出20 ml溶液,其溶质的物质的量浓度是 。将取出的溶液稀释至100 ml,其溶质的物质的量浓度是 。
碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”.实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量NaC1,加热到一定温度,持续通入SO2,待反应一定时间,过滤得到粗碲.
(1)反应的总化学方程式为:TeOSO4+2SO2+3X Te↓+3H2SO4,则X为 (化学式).
Te↓+3H2SO4,则X为 (化学式).
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaC1浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
| 实验 |
温度/℃ |
反应时间/h |
粗蹄沉淀率 |
| a |
65 |
3.0 |
65.0 |
| b |
80 |
3.0 |
98.9 |
| c |
80 |
2.0 |
98.9 |
| d |
90 |
2.0 |
97.0 |
①该小组研究的反应条件是 和 .
②实验a和b的目的是 .
③在上述四组实验中,最佳的反应条件是 ℃和 h.
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率.若再设计对比实验,选择的反应条件还可以是 (填选项).
A.80℃,1.5h B.80℃,2.5h
C.70℃,2.0h D.95℃,2.0h.
水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下: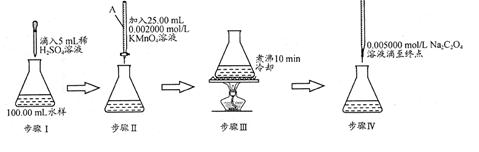
(1)仪器A为 (填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为 。
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42—+ MnO4—+ = Mn2++ CO2↑+
该步骤中KMnO4溶液紫色会逐渐褪去.某探究小组测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.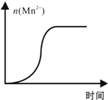
请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00ml,已知滴定后的液面如图所示,请写出滴定前的液面读数 。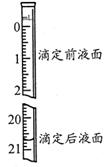
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl—影响
猜想2:配制Na2C2O4标液定容时 。
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl—影响。(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) 。
资料卡片:
1、有机物可被HNO3氧化。
2、AgCl不与酸性KMnO4溶液反应。
3、Ag2C2O4可被酸性KMnO4溶液氧化。
某研究性学习小组做了以下实验:向溴水中加入足量乙醛溶液,观察到溴水褪色的现象。
(1)[提出问题]
产生上述现象的原因是什么?
(2)[提出猜想]
①溴水与乙醛发生取代反应。
②___________________________________________________。
③___________________________________________________。
(3)[设计方案]
方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br2的物质的量和反应后Br-离子的物质的量。
(4)[实验探究]
取含0.005mol Br2的溶液10mL,加入足量乙醛溶液使其褪色,再加入过量AgNO3溶液,过滤、洗涤、干燥后称重固体质量为1.88g。
(5)[解释与结论]
假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)=0 mol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=a mol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=2a mol,则说明溴水与乙醛发生了____________反应。
若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生反应的类型为___________。理由是________________________________________。
其反应的离子方程式为__________________________________________________。
(6)[反思与评价]
方案一是否可行?__________。理由是_______________________________。