在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品。用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
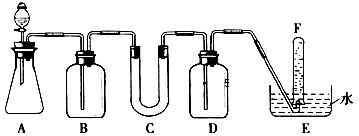
(1)A是利用盐酸和石灰石制取CO2的装置,A中发生反应的化学方程式为_____________.
(2)填写表中空格:
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| C |
|
|
| D |
|
|
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________________。
在此反应中,过氧化钠的作用是_______(填序号) ①氧化剂;②还原剂;③既是氧化剂又是还原剂;④既不是氧化剂,又不是还原剂。
(4)试管F中收集满气体后,下一步实验操作是:___________________________。
下图为两套实验装置。
(1)写出下列仪器的名称:


① ;② 。
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填序号)
(3)若利用装置I制取蒸馏水,还缺少的仪器是 ,将仪器补充完整后进行实验,冷却水从 口进。
(4)现需配制1.0 mol·L-1的NaOH溶液240mL,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是 、 。
(5)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为_____________________。
(6)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为______g,该同学应称量______g NaOH。

(7)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是__________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
右图是硫酸试剂瓶标签上的内容。

(1)该硫酸的物质的量浓度为________________;
(2)实验室用该硫酸配制240mL0.46 mol·L-1的稀硫酸,则
① 需要该硫酸的体积为________mL;
② 有以下仪器: A 烧杯 B 100mL量筒 C 250mL容量瓶
D 500mL容量瓶 E 玻璃棒 F 托盘天平(带砝码)
G 10mL量筒 H 胶头滴管。配制时,必须使用的仪器有______________(填代号);
 ③ 配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列。
③ 配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列。

④ 该同学实际配制得到的浓度为0.45 mol·L-1,可能的原因是_________
| A.量取浓H2SO4时仰视刻度 | B.容量瓶洗净后未经干燥处理 |
| C.没有将洗涤液转入容量瓶 | D.定容时仰视刻度 |
实验室配制500 mL 0.1 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入500 mL容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)计算需要NaCl的质量为__________g,操作步骤的正确顺序为______________(填序号)。
(2)实验中除了用到烧杯、500 mL容量瓶、胶头滴管以外还需要的玻璃实验仪器有_________。
(3)某同学观察液面的情况如图所示,对所配溶液浓度将有何影响?__________(填“偏高”、“偏低”或“无影响”)。
(4)若实验过程中加蒸馏水时不慎超过了刻度线应如何处理?____________________。
工业生产的纯碱中常含有少量的NaCl杂质。某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.

甲 乙 丙 丁
(1)甲装置反应的离子方程式是 。
(2)乙装置反应完成后,再通数分钟空气的作用是 。
(3)若取n g样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为m g,实验结束后称得干燥管丁的总质量为w g,则Na2CO3质量分数的计算式为 。
(4)若去掉丙装置,测得的CO2质量会 (填“偏大” “偏小”或“无影响”)。
(5)有同学认为在丁后面还要再连一个跟丁一样的装置,目的是 。
实验室配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液需要________ml容量瓶。还需要烧杯、玻璃棒、量筒______仪器.
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
A 洗涤 B 量取 C 冷却 转移 D 摇匀 E 定容 F 计算
(3)若出现如下情况,对所配溶液浓度将有何影响?
加蒸馏水时不慎超过了刻度 ;定容时俯视____________未冷却______________.
下图为两套实验装置。
(1)写出下列仪器的名称:


① ;② 。
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填序号)
(3)若利用装置I制取蒸馏水,还缺少的仪器是 ,将仪器补充完整后进行的实验操作的名称为: ,冷却水从 口进。
(4)某学生欲用11.9 mol/L浓盐酸和蒸馏水配制480mL物质的量浓度为0.400 mol/L的稀盐酸.
①其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是 、 。
②将下列操作填写完整,并排列其正确的操作顺序(字母表示,每个字母只用一次)_ _ _ _;
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒准确量取浓盐酸_________ mL,注入烧杯中,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃杯注入_________ 中 |
| D.将容量瓶盖紧,颠倒摇匀 |
E.改用_________ 加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度线_________ 处.
③若配制时,因加水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?________
④在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是__________。
a没有洗涤烧杯和玻璃棒
b转移溶液时不慎有少量溶液洒到容量瓶外面
c容量瓶不干燥,含有少量蒸馏水
d定容时俯视刻度线
e定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液;
乙同学直接加热饱和FeCl3溶液;
丙同学向25 mL沸水中逐滴加入1 mL~2 mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。试回答下列问题:
(1)其中操作正确的同学是 ________;若丙同学实验中不停止加热,会看到____________________。
(2)证明有Fe(OH)3胶体生成的实验操作及现象是_____________________。
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明________________________________。
②向其中加入过量稀硫酸,产生的现象是__________________。
实验室里要配制465 mL 0.2 mol/L的硫酸钠溶液。
(1)请填写下列空白:
| A.计算、称量、溶解:在天平上称出________g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。 |
| B.转移:把得到的溶液冷却后小心地沿着________注入________中。 |
| C.洗涤:用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。 |
| D.定容:继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm,改用________小心滴加蒸馏水至溶液凹液面底部与刻度线相切。 |
E.摇匀:将瓶塞塞紧,充分摇匀。
F.贴标签、装试剂瓶:将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(2)下列情况会使所配溶液浓度偏高的是________(填字母)。
a.某同学定容时俯时容量瓶刻度线
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线又加水了
d.进行B操作时将少量液体洒到外面
e.未冷却至室温就进行转移
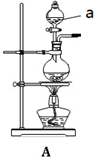
实验室用MnO2和浓盐酸反应制取Cl2,发生装置如图A。
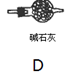
回答下列问题:
(1)仪器a的名称是 。
(2)书写实验室制备氯气化学方程式
(3)制得的气体除去HCl杂质后,为得到干燥的Cl2,应通过 装置(填 “B” “C”或“D”)。
(4)若制得氯气0.56L(标准状况),则被氧化的HCl的物质的量_________mol,并将所得氯气与过量的石灰乳反应,则理论上最多可制得______________g次氯酸钙。
(5)漂白粉在空气中长期放置失效的化学方程式 、 。
实验室欲配制480 mL 0.1 mol•L-1 Na2CO3溶液,请据此回答下列问题:
(1)实验时,应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)在配制Na2CO3溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、 、 。
(3)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是 。(填字母)
| A.容量瓶内壁附有水珠而未干燥处理 |
| B.忘记将洗涤液加入容量瓶 |
| C.定容时俯视刻度线 |
| D.摇匀后发现液面低于刻度线,加水至凹液面恰好与刻度线相切 |
如图是测定铝粉(含铜粉等杂质不与酸反应)的纯度的实验装置。装置为干燥管和锥形瓶,干燥管内装有氯化钙,锥形瓶内所用的硫酸(足量)的物质的量浓度为4mol·L-1。
不同时间电子天平的读数如下表所示:

| 实验操作 |
t/min |
电子天平的读数/g |
| 装置+硫酸溶液 |
|
320.0 |
| 装置+硫酸溶液+样品 |
0 |
335.0 |
| 1 |
334.5 |
|
| 2 |
334.1 |
|
| 3 |
333.8 |
|
| 4 |
333.8 |
(1)反应中生成气体的质量为 。
(2)试计算样品中铝的质量分数?(写出计算过程)
(3)求反应后锥形瓶内硫酸溶液(溶液的体积变化忽略)的物质的量的浓度? (写出计算过程)
下图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置。

试回答:
(1)C、G两个装置所盛放的试剂分别是:
C_____ _____G 。
(2)①装置搭好须进行气密性检查,写出操作方法: 。
②两处酒精灯应先点燃 处(填写A或E),目的是 。
③F中的现象为______________,G中出现了一种沉淀,该沉淀的化学式_____ _。
(3)写出在A、E中发生反应的化学方程式为:
A: 。
E: 。
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br -、I-、SO42-、Na+、Mg2+、Ca2+等,都是重要资源.开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图:

请根据以上信息回答下列问题:
(1)写出步骤②、⑧分离提纯的方法:
② ⑧ 。
(2)步骤⑦分离提纯过程中需要选用的玻璃仪器除烧杯外,还需要的仪器是 。
(3)D具有杀菌消毒的作用,请写出反应④的化学方程式 。
(4)初步提纯后的粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
①盐酸 ②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,
下列试剂添加顺序合理的是 。
A.②③④① B.③④②① C.④③②① D.③②④①
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是 。
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有 性,该方法对比有机溶剂萃取法的优点是 。
(1)下列有关实验操作或判断正确的是 (填序号,多选扣分)。
A.将配制好一定物质的量浓度的溶液,注入含有少量水的试剂瓶中,浓度不受影响。
B.用托盘天平称取5.85g氯化钠固体
C.苯、CCl4可用来萃取溴水中的溴。
D.需要95 mL 0.1 mol/L NaCl溶液,一般用100 mL容量瓶进行配制。
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量。
F.观察钾元素焰色反应的操作是:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,观察观察火焰的颜色。
(2)①容量瓶上含有下列量中的(填写字母)
A 压强 B 温度 C 容积 D 密度 E 刻度线
②用浓硫酸配制500mL2mol∙L-1硫酸溶液时,所需的玻璃仪器除烧杯、量筒、玻璃棒和胶头滴管之外,还需要 (填仪器名称);在下列配制过程示意图中,有错误的是 (填写序号。

③现要用容量瓶配制500mL0.4mol∙L-1Na2CO3溶液,配好的溶液倒入试剂瓶后需要贴上标签。请你帮助把下图标签上的内容填上去。

④下列情况将使配制溶液的物质的量浓度偏低的有 (填序号)。
A. 容量瓶用蒸馏水洗净后,未待干燥便用来配制
B. NaOH溶解后趁热移入容量瓶中
C. 定容时,俯视刻度线
D. 摇匀后发现液面未到刻度线,继续加水至刻度线