浙江省杭州地区七校高一上学期期中联考化学试卷
海水中含有大量的化学元素,自然界中的有些元素主要存在于海水中。下列元素中,被称为“海洋元素”的是
| A.钠 | B.碘 | C.溴 | D.氯 |
浙江海洋经济发展示范区建设已上升为国家战略,海洋经济将成为浙江经济转型升级发展的重点。下列说法不正确的是
| A.从海水中提取溴单质的过程中涉及氧化还原反应 |
| B.从海水中提取氯化钠的过程中涉及化学反应 |
| C.从海带中提取碘单质的过程中涉及置换反应 |
| D.电解饱和食盐水制氯气的过程中涉及氧化还原反应 |
下列有关物质的分类正确的是
| A.CaCl2、NaOH、HCl、HD四种物质都属于化合物 |
| B.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| C.溶液,浊液,胶体都属于混合物 |
| D.CO2 、CO等非金属氧化物均属于酸性氧化物 |
下列物质的水溶液能导电,但属于非电解质的是
| A.HNO3 | B.Cl2 | C.NH4NO3 | D.SO3 |
英国《自然》杂志曾报道,科学家用DNA制造出一种臂长只有7nm的纳米(1nm=10﹣9m)级镊子,这种镊子能钳起分子或原子,并对它们随意组合,下列分散系中分散质的微粒直径与纳米级镊子具有相同数量级的是
| A.溶液 | B.乳浊液 | C.悬浊液 | D.胶体 |
下列化学用语正确的是
| A.硫酸铁的化学式为FeSO4 |
B.氧离子结构示意图:  |
| C.碳酸钠的电离方程式 NaHCO3=Na++HCO3- |
D.质量数为37的氯原子: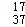 Cl Cl |
下列物质既能由金属和酸反应获得,也能通过金属和氯气反应获得的是
| A.CuCl2 | B.FeCl2 | C.FeCl3 | D.NaCl |
我国科学家在世界上首次合成了三种新核素,其中一种新核素是185Hf(铪)。关于185Hf的下列说法中,正确的是
| A.是一种新元素 | B.是183Hf的一种新的同位素 |
| C.原子核内有185个中子 | D.原子核内有185个质子 |
下列关于科学家及其提出学说与贡献的叙述不对应的是
| A.道尔顿提出原子学说 |
| B.舍勒发现了氯气 |
| C.汤姆生发现电子,并提出原子结构轨道模型 |
| D.卢瑟福根据α粒子散射现象,提出了带核的原子结构模型 |
下列有关氧化还原反应的叙述不正确的是
| A.元素化合价发生变化(升高和降低)的反应一定是氧化还原反应 |
| B.在氧化还原反应中一定发生电子转移(电子得失或电子对偏移) |
| C.化合反应一定是氧化还原反应 |
| D.分解反应不一定是氧化还原反应 |
向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察下图所记录的现象,判断各瓶注入的液体依次是什么。
| A.AgNO3溶液、NaOH溶液、水 | B.NaOH溶液、AgNO3溶液、水 |
| C.水、AgNO3溶液、NaOH溶液 | D.AgNO3溶液、水、NaOH溶液 |
按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是
| A.打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处 |
| B.开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应 |
| C.反应一段时间后,左端液面上升,进入长颈漏斗,a处有无色气体产生 |
| D.若用酒精来代替煤油,可观察到相同的实验现象 |
下列反应中,属于氧化还原反应,但水既不作氧化剂,又不作还原剂的是
| A.Na2O+H2O=2NaOH | B.2F2+2H2O=4HF+O2 |
| C.3NO2+H2O=2HNO3+ NO | D.2Na+2H2O=2NaOH+H2↑ |
向四支试管中分别加入少量不同的无色溶液,再分别进行如下操作,结论正确的是
| |
操作 |
现象 |
结论 |
| A |
滴加BaCl2溶液,再加稀盐酸 |
生成白色沉淀 |
原溶液中有 |
| B |
滴加氯水和CCl4,振荡、静置 |
下层溶液显橙红色 |
原溶液中有Br― |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+、无K+ |
| D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
某化学教师为“氯气与金属钠反应”设计了如下图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是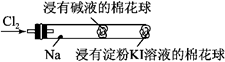
| A.钠着火燃烧产生苍白色火焰 |
| B.反应生成的大量白烟是氯化钠晶体 |
| C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 |
| D.管右端棉球处颜色变化可判断氯气是否被碱液完全吸收 |
已知某气体的摩尔质量为M,一定条件下的摩尔体积为Vm,下列说法正确的是
| A.一个该气体分子的质量为M/NA |
| B.一个该气体分子的体积为Vm/NA |
| C.气体摩尔体积的大小取决于气体分子本身的大小 |
| D.上述说法均不正确 |
同温同压下,等质量的O2和O3相比较,下列结论正确的是
| A.它们的分子数目之比是 1:1 | B.它们的氧原子数目之比为 2:3 |
| C.它们的密度之比为 2:3 | D.它们的体积之比是 1:1 |
在一定温度、压强下,1体积X2(气)和3体积Y2(气)化合成2体积的气体化合物,则该气体化合物的化合式为
| A.XY3 | B.XY | C.X3Y | D.X2Y3 |
用NA表示阿伏加德罗常数,下列说法正确的是
| A.2g氢气所含原子数目为NA |
| B.标准状况下,11.2L H2O所含分子数为0.5NA |
| C.1mol•L-1 CaCl2溶液中所含Ca2+离子的数目为NA |
| D.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为
A.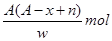 |
B. |
C.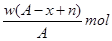 |
D. |
有X、Y、Z三种元素,X原子核内无中子,Y原子的核外有三层电子层,单质在常温常压下是黄绿色气体,Z原子在反应中容易失去一个电子形成稳定的结构 ,和氖具有相同的电子数。按要求回答下列问题:
(1)依次写出X、Z的元素符号: 、 ,画出Y原子结构示意图: 。
(2)元素X、Z形成的化合物与水反应有无色气体产生,反应后的溶液能使酚酞试液变红色,请写出该反应的化学方程式 。
(1) 12.4g Na2R中含Na+0.4mol,则Na2R的摩尔质量为 。
(2)有相同状况下的两种气体12C18O和14N2。若两种气体的质量相等,则12C18O和14N2气体所含质子数之比为 ;若两种气体的分子数相同,则12C18O和14N2的体积之比为 。
被誉为“太空金属”的钛(Ti),在自然界中主要以金红石(TiO2)的形式存在.由于金红石熔点高,为金属Ti的直接制备带来了困难.在工业上常常采用将其先转化成熔沸点较低的TiCl4后再进行还原的方法.金红石转化成TiCl4的反应方程式如下:
TiO2 + 2C + 2Cl2═ TiCl4 + 2CO
(1)用双线桥法标出上述化学方程式的电子转移情况;
(2)指出该反应的氧化剂 ,氧化产物 ;
(3)当消耗标准状况下Cl2 11.2L时,则转移的电子数为 。
(1)下列有关实验操作或判断正确的是 (填序号,多选扣分)。
A.将配制好一定物质的量浓度的溶液,注入含有少量水的试剂瓶中,浓度不受影响。
B.用托盘天平称取5.85g氯化钠固体
C.苯、CCl4可用来萃取溴水中的溴。
D.需要95 mL 0.1 mol/L NaCl溶液,一般用100 mL容量瓶进行配制。
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量。
F.观察钾元素焰色反应的操作是:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,观察观察火焰的颜色。
(2)①容量瓶上含有下列量中的(填写字母)
A 压强 B 温度 C 容积 D 密度 E 刻度线
②用浓硫酸配制500mL2mol∙L-1硫酸溶液时,所需的玻璃仪器除烧杯、量筒、玻璃棒和胶头滴管之外,还需要 (填仪器名称);在下列配制过程示意图中,有错误的是 (填写序号。

③现要用容量瓶配制500mL0.4mol∙L-1Na2CO3溶液,配好的溶液倒入试剂瓶后需要贴上标签。请你帮助把下图标签上的内容填上去。

④下列情况将使配制溶液的物质的量浓度偏低的有 (填序号)。
A. 容量瓶用蒸馏水洗净后,未待干燥便用来配制
B. NaOH溶解后趁热移入容量瓶中
C. 定容时,俯视刻度线
D. 摇匀后发现液面未到刻度线,继续加水至刻度线
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br -、I-、SO42-、Na+、Mg2+、Ca2+等,都是重要资源.开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图:

请根据以上信息回答下列问题:
(1)写出步骤②、⑧分离提纯的方法:
② ⑧ 。
(2)步骤⑦分离提纯过程中需要选用的玻璃仪器除烧杯外,还需要的仪器是 。
(3)D具有杀菌消毒的作用,请写出反应④的化学方程式 。
(4)初步提纯后的粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
①盐酸 ②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,
下列试剂添加顺序合理的是 。
A.②③④① B.③④②① C.④③②① D.③②④①
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是 。
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有 性,该方法对比有机溶剂萃取法的优点是 。
下图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置。

试回答:
(1)C、G两个装置所盛放的试剂分别是:
C_____ _____G 。
(2)①装置搭好须进行气密性检查,写出操作方法: 。
②两处酒精灯应先点燃 处(填写A或E),目的是 。
③F中的现象为______________,G中出现了一种沉淀,该沉淀的化学式_____ _。
(3)写出在A、E中发生反应的化学方程式为:
A: 。
E: 。
下图是“康师傅”牌饮用矿泉水的标签的部分内容。请认真阅读标签内容,计算:

(1)镁离子的物质的量浓度的最大值是 。
(2)一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过 mol
如图是测定铝粉(含铜粉等杂质不与酸反应)的纯度的实验装置。装置为干燥管和锥形瓶,干燥管内装有氯化钙,锥形瓶内所用的硫酸(足量)的物质的量浓度为4mol·L-1。
不同时间电子天平的读数如下表所示:

| 实验操作 |
t/min |
电子天平的读数/g |
| 装置+硫酸溶液 |
|
320.0 |
| 装置+硫酸溶液+样品 |
0 |
335.0 |
| 1 |
334.5 |
|
| 2 |
334.1 |
|
| 3 |
333.8 |
|
| 4 |
333.8 |
(1)反应中生成气体的质量为 。
(2)试计算样品中铝的质量分数?(写出计算过程)
(3)求反应后锥形瓶内硫酸溶液(溶液的体积变化忽略)的物质的量的浓度? (写出计算过程)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号