实验室用MnO2粉末与浓盐酸共热制取氯气:
MnO2+4HCl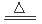 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
实验Ι 验证氯气能否与水反应
某同学设计了如下图所示的实验装置:
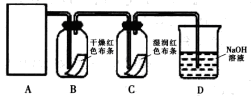
(1)从下图选择适合A处的装置__________(填序号)。
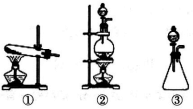
(2)装置B中能否观察到预期的实验现象?_________(填“能”或“不能”),请说明理由______________。
实验II 测定反应后A中残余盐酸的浓度
步骤一:配制100mL1.00mol∙L-1的NaOH溶液,配制过程如下:
①称量_______gNaOH固体,在烧杯中用适量蒸馏水溶解,冷却。
②将烧杯中的溶液转移至________中,并用少量蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液也注入容量瓶中。
③继续加蒸馏水至离刻度线1~2cm处,改用_________滴加蒸馏水至凹槽面最低处与刻度线相切。
④盖上瓶塞,上下颠倒摇匀,将所配溶液转移至指定试剂瓶中,贴上标签。
步骤二:取2.00mL反应后A中的溶液,稀释后滴加步骤一配制所得NaOH溶液,恰好完全反应时,消耗NaOH溶液的体积为11.80mL。
(3)完成步骤一的空格。
(4)根据实验数据,计算反应后A中残余盐酸的浓度为_________mol∙L-1。
(5)某同学欲通过测Cl-浓度来推测反应后A中残余盐酸的浓度,取2.00mL反应后A中的溶液,加入2.00mol∙L-1AgNO3溶液至不再产生沉淀时,发现所加的AgNO3溶液的体积远大于理论值5.80mL,其原因是____________。
苯甲酸(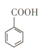 )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
| |
相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
水中溶解度 |
| 苯甲酸 |
122 |
1.27 |
249 |
微溶 |
| 乙醇 |
46 |
0.789 |
78.3 |
易溶 |
| 苯甲酸乙酯 |
150 |
1.05 |
212.6 |
难溶 |
实验方案为:
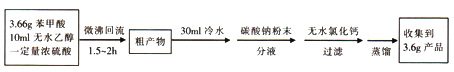

(1)仪器甲的名称为________________。
(2)①往丙中加入药品的顺序为_________________。
A.无水乙醇、浓硫酸、苯甲酸晶体 B.浓硫酸、苯甲酸晶体、无水乙醇
C.苯甲酸晶体、无水乙醇、浓硫酸 D.苯甲酸晶体、浓硫酸、无水乙醇
②若加热反应后发现未加沸石,应采取的正确操作是_____________。
③微沸回流过程中,可以看到乙内的混合试剂的颜色变为_______色。
(3)加入碳酸钠粉末的作用是__________________。
(4)分液要用到的玻璃仪器有__________,粗产物在_______层(填“上”或“下”)。
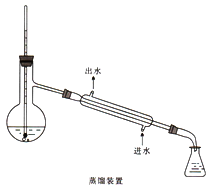
(5)加热蒸馏若采用下图装置(加热装置已经略去)进行,该装置存在的2个问题为__________、________。
(6)本实验所得到的苯甲酸乙酯产率为______________。
(7)装置乙的作用为____________________
研究性学习小组探究金属锈蚀的条件,进行如下对照实验:

(1)数天后铁钉明显锈蚀的装置是 ;
(2)铁制品锈蚀的条件是 ;
(3)铁钉生锈主要属于 腐蚀(填“化学”或“电化学”);
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用图9所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白:
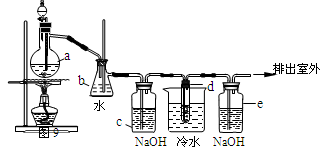
(1)烧瓶a要求温度迅速升高到170℃发生反应,写出该反应的化学方程式 ;该反应类型为 。
(2)写出制备1,2-二溴乙烷的化学方程式 。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象 。
(4)容器c中NaOH溶液的作用是 ;e装置内NaOH溶液的作用是 。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(至少2点) 、 。
明矾石是制取钾肥和氢氧化铝的重要原料。明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示: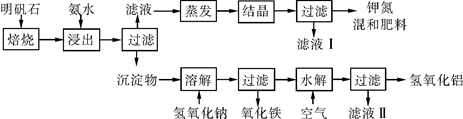
根据上述图示,完成下列填空。
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有250.28 g氨)__________mL,用规格为__________mL量筒量取。
(2)写出沉淀物中所有物质的化学式:____________________。
(3)滤液Ⅰ的成分是水和________________________________。
(4)为测定混合肥料 K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
④若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为___________mol(用含m、n的代数式表示)。
探究SO2的性质。甲组同学将SO2分别通入下列3种溶液中。
(1)试管a中观察到的现象是_____________。
(2)试管b中观察到紫色褪去,说明SO2具有的性质是_____________。
(3)试管c中产生了能溶于稀盐酸的白色沉淀,该白色沉淀是_____________。
(4)乙组同学多做了一组实验,他们将SO2通入盛有1.0 mol/L Fe(NO3)3和BaCl2的混合溶液(已 知1.0 mol/L Fe(NO3)3溶液中c(H+)=0.1 mol/L)的试管d中,得到了不溶于稀盐酸的白色沉淀。分析产生该白色沉淀的原因:
观点1:SO2与Fe3+反应
观点2:在酸性条件下SO2与NO3-反应
观点3:__________。
欲证明观点2,只需将试管d中Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是__________(填字母)。
a. 0.1 mol/L稀硝酸
b. 1.5 mol/L Ba(NO3)2和0.1 mol/L HNO3的混合溶液
c. 6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
为了将混有Na2SO4、NaHCO3的NaCl提纯,并制得纯净的溶液,某学生设计了如图所示的实验方案:
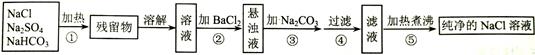
(1)操作①盛放药品可选用 (填仪器名称)。操作①中发生反应的化学方程式是: 。
(2)操作②为什么不用Ba(NO3)2溶液,其理由是 。
(3)进行操作②后,如何判断杂质已除尽?方法是 。
(4)操作③的目的是 ;为何不先过滤后加Na2CO3溶液,其理由是 。
(5)此设计方案是否严密?请说明理由 。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”,并收集纯净干燥的气体。请回答该实验中的问题。
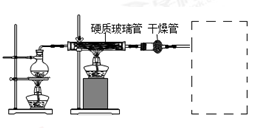
(1)写出该反应的化学方程式 ;干燥剂是_________(写名称)。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,其作用是 。
(3)试管中收集气体是 (写化学式),如果要在A处玻璃管处点燃该气体,则必须对该气体进行 。在虚线框内画出收集该气体的装置图。(限选仪器:试管、玻璃导管、水槽)
(4)反应后得到黑色固体,主要成分是Fe3O4,还含有少量Fe和FeO;限选以下试剂:稀HNO3、稀HCl、KSCN溶液、氯水、CuSO4溶液;
设计实验方案检验所得固体中含有Fe3O4,写出实验步骤和实验现象_____________。
‚证明固体中含有没完全反应的Fe____________________________。
根据题目要求填空:
(1)硫、氮的氧化物是主要的大气污染物,对大气的影响之一是导致酸雨。用化学方程式表示NO2形成酸雨的原因: ,该反应中氧化剂和还原剂的物质的量之比为 。
(2)实验室常用的几种气体发生装置如图A、B、C所示:
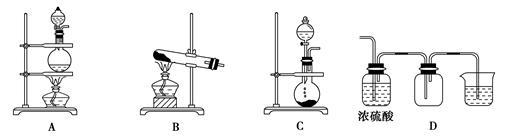
实验室可以用B或C装置制取氨气,如果用B装置,反应的化学方程式是______________;如果用C装置,通常使用的药品是______________(写名称);
‚下图是某学生设计收集氨气的几种装置,其中可行的是______________。
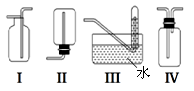
ƒ若用A装置与D装置相连制取并收集X气体,则X可能 是下列气体中的_____________
A.CO2 B.NO C.Cl2 D.H2
写出A装置中反应的离子方程式_______________。
(3)氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
氢化钠(NaH)中Na元素的化合价为+1,在高温下氢化钠(NaH)可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为 。
‚NaH能与水剧烈反应:NaH+H2O===NaOH+H2↑,NaH与液氨(NH3)也有类似反应,该反应的化学方程式为_________________________。
如果有12g NaH参加此反应,则转移电子的物质的量为________mol
(4)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):
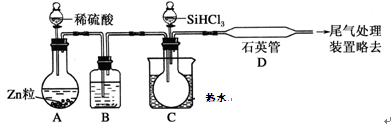
SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:_____________;H2还原SiHCl3过程中若混入O2,可能引起的后果是___________;
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)小组同学在实验时,当打开A的分液漏斗的下面活塞后,发现漏斗内的液体未流下,其原因可能是 。
(2)配平装置E中反应的化学化学方程式:
MnO2 + HCl(浓) MnCl2 + +
MnCl2 + +
(3)A、E均开始反应,当观察到B、D中的品红溶液均已褪色时,停止反应通气。取下B、D两个试管,分别加热,出现的现象是 。
(4)当小组同学将SO2和Cl2按体积比1:1,同时通入到品红溶液时,观察到品红溶液几乎没有出现褪色现象,分析其原因可能是(用化学用语表示) 。
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是
| A.上下移动①中铜丝可控制生成SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.该反应中浓硫酸体现了强氧化性和脱水性 |
为研究A的组成与结构,某同学进行了如下实验:
| 实 验 步 骤 |
实 验 结 论 |
| (1)将9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4 g和13.2 g。 |
(1)A的实验式为 。 |
| (2)通过质谱法测得其相对分子质量为90。 |
(2)A的分子式为 。 |
| (3)另取9.0 g A,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 |
(3)A中含有的官能团名称为 。 |
| (4)A的核磁共振氢谱有四组吸收峰,其峰面积之比为2︰2︰1︰1。 |
(4)综上所述,A的结构简式为 。 (5)写出A与NaHCO3反应的化学方程式 。 |
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由 色变为 色,并______为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )

| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL,所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积/mL |
0.100 0 mol·L-1盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度。
研究物质的合成或制备是有机化学、无机化学的重要任务之一。
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了以下装置:
①分液漏斗中的A物质是________________(填试剂名称)。
②利用中学常见的仪器,在答题卡中补充完整实验装置(不必画出夹持装置)。可选择的试剂有:稀NaOH溶液、无水氯化钙、稀硫酸、浓硫酸。
③假设实验过程中MgCl2▪6H2O未水解,不用任何试剂用最简单的方法检验MgCl2▪6H2O是否完全转化为MgCl2。写出实验方法________________。
④工业生产中得到无水氯化镁可用于电解制备镁单质,电解装置中,镁在____极析出。
(2)实验室制备并收集纯净乙烯
①有的同学通过乙醇发生消去反应进行实验。除乙醇外,所需的试剂或用品(不包括仪器)有_________________。
②有的同学探究其它制备乙烯的方法,他设计了以下装置制备乙烯。实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,请分析气体产率很低的原因主要是______________________。为增大气体产率,在下图装置的基础上,提出一点改进措施__________________。
从实验安全角度考虑,该实验很可能发生的问题是________________。
[实验化学]
水杨酸可用于制备解热镇痛药阿司匹林。重结晶纯化固体水杨酸的步骤如下:
步骤1:按图1所示装置,在圆底烧瓶中加入1.2 g粗水杨酸,10 mL 30%乙醇和磁子。接通冷凝水后,搅拌加热至沸,直到完全溶解。
步骤2:冷却后,加入活性炭,重新搅拌加热煮沸几分钟后,利用图2装置趁热过滤到锥形瓶中,并在短颈漏斗上盖好表面皿。
步骤3:盛滤液的锥形瓶用塞子塞好,自然冷却后再用冰水冷却,析出水杨酸晶体。
步骤4:用图3所示装置进行抽滤,用少量30%的乙醇洗涤。抽干后得到的晶体转移到表面皿上,放入干燥器中干燥。
步骤5:称量干燥后固体质量为0.81 g。
(1)步骤1中接通冷凝水时,冷水应从________(填“A”或“B”)端进。
(2)步骤2中“趁热过滤”的目的是______________________。
(3)步骤3中“自然冷却后再用冰水冷却”,而不直接用冰水浴冷却的目的是________。
(4)步骤4中C装置的作用是______________________________________。
(5)本次实验中,水杨酸的收率为________。确定最终产品是水杨酸的实验或方法是___________。