(1)酯化反应: 跟 作用而生成 和 的反应。
(2)断键规律:酸去 基醇去 。
(3)右图为乙酸和乙醇在一定条件下制取乙酸乙酯的实验,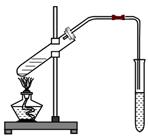
试叙述:该实验反应现象:
反应化学方程式: 。
说明:①药品加入顺序:浓硫酸一定不能第一个加入。
②浓硫酸的作用:
③饱和碳酸钠作用:
④此反应是可逆反应
⑤长导管不能伸入到液面以下:
有下列化学仪器:
①托盘天平②玻璃棒③药匙④烧杯⑤量筒⑥容量瓶⑦胶头滴管⑧细口试剂瓶⑨标签纸
(1)现需要配制500m L 1mol/L H2SO4溶液,需要质量分数为98%,密度为1.84g/cm3的浓H2SO4 ;
(2)从上述仪器中,按实验要求使用的先后顺序,其编号排列是 ;
(3)容量瓶使用前检验漏水的方法是 ;
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”“偏低”或“不变”)
①用以稀释浓硫酸的烧杯未洗涤, ;
②未经冷却将溶液注入容量瓶中, ;
③摇匀后发现液面下降再加水, ;
④定容时观察液面俯视, 。
有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
(1)盛______________(填化学式)的试管中气球变得更大, 大小气球(不计气球的弹力和气体温度影响) 体积之比约为(填最简单整数比)____________。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了如下热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+ H+(aq) →H2O(l)+ CO2(g) ΔH1;ΔH1>0
CO32-(aq)+ 2H+(aq) → H2O(l) + CO2(g) ΔH2 ;ΔH2<0
甲同学所作结论的方法是否正确?___________(填“正确”或“不正确”)。
(3)为研究该反应是吸热还是放热反应,某研究小组以《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》为研究课题,进行了如下实验(每次实验各做三次,取平均值):
| 序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高 或最低温度 |
| ① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
| ② |
35mL水 |
3.2 Na2CO3固体 |
20℃ |
24.3℃ |
| ③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
| ④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL+10ml水 |
20℃ |
24.2℃ |
| ⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
| ⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和_______________;
(4)通过上述实验可以得出_____________(填字母编号)。
| A.NaHCO3的溶解是吸热过程 |
| B.NaHCO3的饱和溶液和盐酸的反应是吸热反应 |
| C.Na2CO3的溶解是放热过程 |
| D.Na2CO3的饱和溶液和盐酸的反应是吸热反应 |
(5)结论:影响NaHCO3固体与稀盐酸反应的反应热因素有________________________________________________________________________。
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)大烧杯上如不盖硬 纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由_________________________________。
《硫酸铜晶体里结晶水含量的测定》是中学化学中的重要实验,请回答下列该实验的相关问题。
(1)实验中能直接加热的仪器名称为____________;进行的称量操作至少为________次。
(2)下列操作会引起测定结果偏高的是__________________
| A.加热时温度过高CuSO4发生分解 | B.加热后在空气中冷却再称量 |
| C.加热过程中有晶体溅出 | D.晶体部分风化 |
二氯化二硫(S2C12)在工业上用于橡胶的硫化。为了在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:
①在110℃~ 140℃时,将干燥的氯气与硫反应可得到S2C12的粗产品。 ②有关物质的部分性质如下表:
②有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
| S |
112.8 |
444.6 |
略 |
| S2C12 |
-77 |
137 |
S2C12遇水生成HCl、SO2、S,300℃以上完全分解; S2C12 + C12 2SCl2 2SCl2 |
| SCl2 |
-121 |
59.6(分解) |
设计实验装置如下图:
(1)仪器A,B的名称分别为______________,______________。
A中发生反应的离子方程式为 。
C中的试剂名称是______________;仪器D的作用是 。
(2)上图中装置不够完善,请你提出改进意见 ;
利用改进后的正确装置进行实验,请回答下列问题:
(3)E中反应的化学方程式为_____________________________________________。
(4)如果在加热E时温度过高,对实验结果的影响是_________________________,
在F中可能出现的现象是_________________________________________。
(5)S2C12粗品中可能混有的杂质是 、 、___________,为了提高S2C12的纯度,关键的操作是控制好温度和______________________。
实验题:现有药品:W g(W<1)锌片、稀硫酸、无水硫酸铜、氧化铜和水。请从图中选用适当的实验装置,设计一个简单的实验,粗略测定锌的相对原子质量(假设环境为标准状况)。
(1)应选用的装置是(只要求写出图中装置的标号) 。
(2)所用装置的连接顺序是(填各接口的字母,胶管省略) 。
(3)为了保证不漏出氢气,操作中加放试剂 的方法是 。
的方法是 。
(4)用实验所测得的数据,写出计算锌的相对原子质量的数学式:Mr(Zn)= 。
(8分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
 ①2Mg+O2
①2Mg+O2 2MgO;
2MgO;
②3Mg+N2 Mg3N2;
Mg3N2;
③2Mg+CO2 2MgO+C;
2MgO+C; ④Mg+H2O
④Mg+H2O MgO+H2↑;
MgO+H2↑;
⑤Mg3N2 +6H2O =3Mg(OH)2↓+2NH3↑
 可供选择的装置和药品如上图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
可供选择的装置和药品如上图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。 回答下列问题
回答下列问题



 (1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号) 。
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号) 。 (2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号) 。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号) 。 (3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?
,原因是 。 (4)请设计一个实验,验证产物是氮化镁: 。
(4)请设计一个实验,验证产物是氮化镁: 。
(8分)某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
如图所示,A是制取溴苯的实验装置,B、C是改进后的装置。请仔细分析,对比三个装置,回答下列问题:
(1)写出三个装置中共同发生反应的化学方程式:___________________
(2)装置A和C均采用了长玻璃导管,其作用是_____________________________
(3)按装置B、C装好仪器及药品后,要使反应开始,应对装置B进行的操作是_________,应对装置C进行的操作是 ___________________________________ 。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作,装置A中这一问题在实验中造成的后果是________________________ 。
(5)B中采用了洗气瓶吸收装置,反应后洗气瓶中可能出现的现象是_______
(10分)实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2。
(1)装置中X仪器的名称是: ;
碎瓷片的作用是: 。
(2)写出生成乙烯的化学反应方程式: 。
(3)A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号):
①品 红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
A. ;B. ;C. ;D. 。
(4)能说明SO2气体存在的现象是 。
(5)确证含有乙烯的现象是 。
(8分)请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及分离方法的编号填入表中。
试 剂: a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO
分离方法:①.分液 ②.过滤 ③.洗气 ④.蒸馏
| 混合物 |
需加入的试剂 |
分离方法 |
| 溴苯(溴) |
|
|
| 乙烷(乙烯) |
|
|
| 乙醇(水) |
|
|
| 乙酸乙酯(乙酸) |
|
|
下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题:湖北
(1)方框内装置用来制取乙烯,现有下列仪器及用品:①碎瓷片②石棉网和铁架台③圆底烧瓶④温度计(量程100℃)⑤温度计(量程200℃)⑥酒精灯⑦单孔塞⑧双孔塞⑨导管。
其中不需用的仪器及用品有 (填序号)湖北
(2)写出制乙烯化学方程式:
(3)碱石灰的作用是:
(4)溴水的作用是:
(5)出现什么现象可说明生成了乙烷?
为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。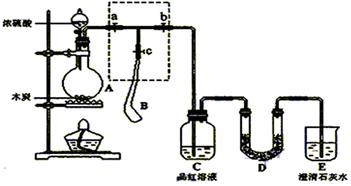
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是 ;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是 (用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为 ;
(4)当D中产生 (多选不得分)现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
装置D的作用为
发生反应用化学方程式可表示为 。
实验室制得的氯气通常含有水蒸气和盐酸挥发的氯化氢,要制取干燥纯净的氯气,可用如图所示的装置,进行干燥、净化、收集和尾气处理(C瓶用于收集氯气,D瓶用于尾气处理)。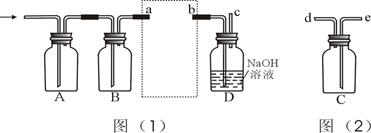
据此完成下列各题:
(1)实验室通常用饱和食盐水吸收杂质HCl,则图(1)中A瓶和B瓶依次分别盛装的试剂是:_____________________________________;
(2)图(2)是氯气的收集装置,将它安置在图(1)中的虚线框内,其导管的连接顺序是:______________________________;
(3)检查最终尾气排放(导管口c处)是否含有氯气,可用湿润的淀粉-KI试纸测试,如有氯气泄漏,可观察到__________________________________,产生此现象的直接原因是__________________________________;此方法检测氯气,试纸必须用水润湿是因为________________________________________。