试回答下列问题:
(1)下列实验中所选用的仪器或操作以及结论不合理的是___ _。
| A.用托盘天平称量11.7g氯化钠晶体 |
| B.加热NH4Cl晶体时,用湿润红色石蕊试纸靠近试管口,检验NH3的生成 |
| C.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠 |
| D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上与标准比色卡比较 |
E.仅用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4和CH3COOH溶液
F.用锌和稀硫酸制H2时,为了使制取H2的速率加快,可以向稀硫酸溶液中加入少量CuSO4溶液
G.用碱式滴定管量取20.00mL 0.1000mol/L的KMnO4溶液;
H.不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
I.用瓷坩埚高温熔融 和
和 固体混合物;
固体混合物;
J.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备 胶体;
胶体;
K.配制 饱和溶液时,加入少量的稀硫酸.
饱和溶液时,加入少量的稀硫酸.
(2)欲量取20.00mL Na2CO3溶液,应选用的仪器是 。
(3)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、 、 。
(4)在硫酸铜晶体中结晶水含量的测定实验中,称量操作至少要进行 次。
实验室常利用甲醛法测定某(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO = 4H+ +(CH2)6N4+6H2O,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤①用电子天平准确称取样品1.5000 g。
步骤②将样品溶解并冷却后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤③移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点。重复步骤③操作2次。
(1)根据步骤③填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数将 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积将
(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变为 色,半分钟内不退色。
⑤滴定后俯视读数,测得样品中氮的质量分数将 (填“偏高”、“偏低”或“无影响”)。
(2)滴定结果如下表所示:
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.02 |
21.04 |
| 2 |
25.00 |
2.00 |
22.00 |
| 3 |
25.00 |
0.20 |
20.21 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数为 。(保留两位小数)
(16分)二氧化钛是一种不溶于稀酸的物质,常用于制取金属钛。某种金红石矿石的主要成分是TiO2,含有Fe2O3和Al2O3杂质。一研究性学习小组设计如下方案制备金属钛,并得到其它副产品。
(1)已知Fe(OH)3、Al(OH)3,开始沉淀的pH数据(见下表)
| 氢氧化物 |
Fe(OH)3 |
A1(OH)3 |
| 开始沉淀pH |
1.5 |
3.3 |
向溶液I中滴加NaOH溶液,并调溶液pH,若开始只得到一种沉淀,该沉淀是
,应控制pH的范围是 ,反应的离子方程式是 ;
(2)向溶液Ⅱ中“继续加适量NaOH溶液”,若操作不当会减少滤渣Ⅲ的质量,请你设计另一种方案代替向溶液Ⅱ中“继续加适量NaOH溶液”的方案,该方案是 ,反应的离子方程式是 ;
(3)已知:①CO2(g)==C(s)+O2(g); △H="393.5" kJ·mol-l
②CO(g)+ O2(g)==CO2(g); △H=-283 kJ·mol-l
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g);△H ="141" kJ·mol-l
写出TiO2与Cl2+C反应的热化学方程式 。
(4)若经过多步反应后制得b g金属钛,则金红石矿石中TiO2的质量分数为
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO  N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:
N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:
(1)A中发生反应的化学方程式是 。
检验氨气通常采用的方法是________ _,其现象是__ ________。
(2)B中加入的物质是 ,其作用是 。
(3)实验时C中观察到的现象是  ,该反应中氨的作用是_______(填氧化剂或还原剂)。
,该反应中氨的作用是_______(填氧化剂或还原剂)。
(4)实验时在D中收集到的液态物质是 ,E中收集到的气体是__________。
(5)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,(一种类似于U型管作用,内装固体干燥剂的管子)第一个干燥管X内装有______,现象是_______;第二个干燥管Y内装有碱石灰,作用是_____________。
四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分别为:
TiO2 +2C+2Cl2 TiCl4 +2CO ;TiCl4 +2Mg
TiCl4 +2CO ;TiCl4 +2Mg 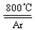 Ti + 2MgCl2
Ti + 2MgCl2
下图是实验室制备TiCl4的反应装置,主要操作步骤:

①连接好整套装置,在通Cl2前先从侧管中通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中反应的离子方程式为__________________________________ 。
⑶ 装置D中冷凝管进水口的位置是(填a或b)___ 。
⑷ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑸工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,氩气的作用为__ 。
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。在实验室里按下图所示装置,可进行模拟实验证明Na2O2的供氧作用。

(1)A中发生反应的离子方程式是 。
(2)填写表中空格。
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| D |
|
|
(3)试管F中收集满气体后,验证该气体的实验操作方法是 。
(4)C中反应的化学方程式是 。
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图。该实验的主要操作步骤如下:

①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②用 量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③用精确的天平分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:
⑵本实验中应选用 (填序号)的量筒。 A.100 mL B.200 mL C.500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm= 。
⑷简述速率不等的原因 ,铜丝不与酸接触的原因是 。
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成。如图是用燃烧的方法确定有机物分子式的常用装置。
试回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是_____________ 。
(2)C装置中浓硫酸的作用是_______________。
(3)燃烧管中CuO的作用是_______________。
(4)若准确称取0.48 g样品,经充分燃烧,A管质量增加1.32 g,B管质量增加1.0 8 g,则该有机物是否含氧元素 ? ______填(有、无)该有机物的分子式为_______
8 g,则该有机物是否含氧元素 ? ______填(有、无)该有机物的分子式为_______
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
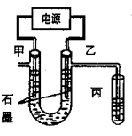
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为_________________。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测,甲电极附近溶液的pH=a,此时甲电极附近c(Cu2+)="________" mol·L-1。(已知:Cu(OH)2的Ksp=2.2*10-20)。
某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 |
现象 |
结论及解释 |
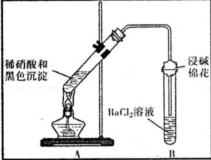 |
①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 |
a.现象②说明褐色沉淀具有 性. b.试管B中产生白色沉淀的总反应的离子方程式为 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2溶液反应完全.则混合物中Cu2S 的质量分数为 .
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):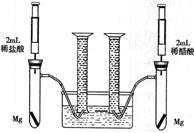
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为____________________。
(2)在上述实验方案中有一明显欠缺,该欠缺是____________。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是____________;最终产生氢气体积的关系应是_______________。
(4)实验中产生的氢气体积比理论值高,可能原因是_______________________。
(5)通过比较起始反应的速率可以得出的结论是______________。
(6)除上述方法外,还可以通过其他方向比较盐酸和醋酸的酸性,请写出其中的一种方法_________。
某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm |
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____________________________ ______;
(2)操作中锥形瓶下垫一张白纸的作用是___________________________________________;
(3)判断到达滴定终点的实验现象是_________________________________ ____;
(共6分)实验室制取SO2的反应原理之一为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:( ×100℅)
×100℅)
(1)这些装置的连接顺序(按气体左右的方向)是 → → → → → → → → (填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
(9分)8.34gFeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。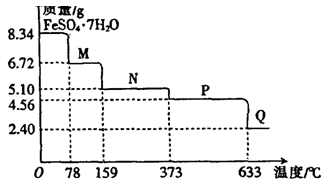
请回答下列问题:
(1)试确定78℃时固体物质M的化学式: 。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,写出该反应的化学方程式 。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。
①试剂X的名称是 。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ 。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量 (填计算式) 。
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)混合①中使用冰水的目的是 。
(3)操作Ⅱ和操作Ⅲ的名称分别是 、 。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为 。