某化学课外小组用右图装置制取溴苯并探究该反应的类型。先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式:________________________________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_________________________。
(3)C中盛放CCl4的作用是_____________________________。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
| |
向试管D中加入的试剂 |
能证明苯与液溴发生取代反应的现象 |
| 方法一 |
|
|
| 方法二 |
|
|
(8分)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是: KIO3+5KI+3H2SO4 =3I2+3H2O+3K2SO4
=3I2+3H2O+3K2SO4
(1)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,震荡,这时候,观察到的现象是___________________________;
(2)某学生在一次分液操作中发现溶液都是无色液体,无法知道分液漏斗中的液体哪一层是有机层,哪一层是水层,请你用简单的方法帮他鉴别出来,写出有关步骤及判断依据: 。
(3)上面实验中用到一定物质的量浓度的稀硫酸,现用浓硫酸配制该稀硫酸,下面操作造成所配稀硫酸溶液浓度偏高的是_____________
A.溶解的时候溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
(4)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
(1)指出上述提取碘的过程中有关实验操作的名称和所需主要实验仪器:
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③ ,步骤⑤ 。
(2)写出步骤④对应反应的离子方程式: 。
(3)步骤④除了加入过量Cl2,下列氧化剂最好选用 (填代号)。
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
理由是 。
(4)提取碘的过程中,可供选择的有机试剂是 。(填编号)
A.酒精 B.醋酸 C.四氯化碳 D.苯
(5)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 。
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 ,烧杯间填满碎塑料泡沫的作用是 .
(2)大烧杯上如不盖硬纸板,则求得的中和热数值 (填“偏大”、“偏小’、“无影响”)
(3)实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热的数值 (填“相等”或“不相等”).
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(1)为了使 转化为
转化为 ,试剂①可以选用 ,要使
,试剂①可以选用 ,要使 完全转化为沉淀,加入试剂①的量应 ;
完全转化为沉淀,加入试剂①的量应 ;
(2)加入试剂①后,能够分离得到 沉淀的方法是 ;
沉淀的方法是 ;
(3)试剂②可以选用 ;
(4)无水 在熔融状态下,通电后会产生
在熔融状态下,通电后会产生 和
和 ,该反应的化学方程式为:
,该反应的化学方程式为:
。
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验: 
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式 _____;装置C的作用是 。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此处B中的现象是________________,B的作用是________________。
化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品。根据产物的质量确定有机物的组成。
回答下列问题:
(1)A装置中分液漏斗盛放的物质是 ,写出有关反应的化学方程式: 。
(2)C装置(燃烧管)中CuO的作用是 。
(3)写出E装置中所盛放物质的名称 ,它的作用是 。
(4)若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种)。经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为 。
某校化学课外小组的学生为了验证乙醇的分子结构,设计如下实验程序:乙醇的精制、乙醇组成元素的测定、分子式的测定、分子结构的测定。
(1)若所用乙醇中含少量水,采用直接蒸馏的方法不能有效除去水,通常向其中加入 ,然后蒸馏。证明乙醇不再含水,可用一种试剂检验,这种试剂是 。
(2)用燃烧乙醇分析产物的方法确定含有C、H、O三种元素。
a.证明含有H元素的操作是 。
b.证明含有O元素时,需取得的实验数据是:CO2的质量,H2O的质量及 。
(3)为确定乙醇的分子式,在通过(2)获取乙醇的实验式之后,是否必须再测定乙醇的相对分子质量才能确定其分子式 (答“是”或“否”),理由是 。
(4)测定乙醇的分子结构
a.若采用红外光谱仪测定,则通过所得红外光谱中有 键的振动吸收峰,即可确定乙醇的结构是CH3CH2OH而不是CH3OCH3。(填“C—H”,“C—C”,“C—O”,“O—H”)
b.若采用核磁共振仪测定,则所得乙醇的核磁共振氢谱上应有 个吸收峰。
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
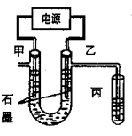
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为_________________。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测,甲电极附近溶液的pH=a,此时甲电极附近c(Cu2+)="________" mol·L-1。(已知:Cu(OH)2的Ksp=2.2*10-20)。
某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 |
现象 |
结论及解释 |
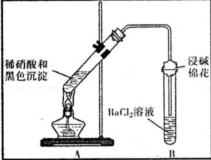 |
①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 |
a.现象②说明褐色沉淀具有 性. b.试管B中产生白色沉淀的总反应的离子方程式为 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2溶液反应完全.则混合物中Cu2S 的质量分数为 .
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):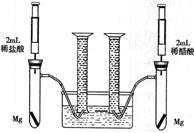
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为____________________。
(2)在上述实验方案中有一明显欠缺,该欠缺是____________。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是____________;最终产生氢气体积的关系应是_______________。
(4)实验中产生的氢气体积比理论值高,可能原因是_______________________。
(5)通过比较起始反应的速率可以得出的结论是______________。
(6)除上述方法外,还可以通过其他方向比较盐酸和醋酸的酸性,请写出其中的一种方法_________。
某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm |
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____________________________ ______;
(2)操作中锥形瓶下垫一张白纸的作用是___________________________________________;
(3)判断到达滴定终点的实验现象是_________________________________ ____;
(共6分)实验室制取SO2的反应原理之一为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:( ×100℅)
×100℅)
(1)这些装置的连接顺序(按气体左右的方向)是 → → → → → → → → (填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
(9分)8.34gFeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。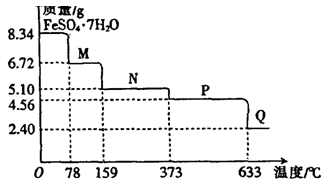
请回答下列问题:
(1)试确定78℃时固体物质M的化学式: 。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,写出该反应的化学方程式 。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。
①试剂X的名称是 。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ 。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量 (填计算式) 。
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)混合①中使用冰水的目的是 。
(3)操作Ⅱ和操作Ⅲ的名称分别是 、 。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为 。