在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应,放出大量气体,反应过程表示如下:
①H2O2+2KI+H2SO4====I2+K2SO4+2H2O
②H2O2+I2====2HIO
③H2O2+2HIO====I2+O2↑+2H2O
(1)H2O2在反应③中的作用是___________(填正确选项的标号)。
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂,又是还原剂 | D.既不是氧化剂,也不是还原剂 |
(2)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为_____________(填“对”或“不对”),其理由是_______________________。
(3)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是____________。
(4)已知H2O2+2KI I2+2KOH,试用H2O2、KI溶液、淀粉溶液、水等药品,设计一个实验来说明与一定量H2O2反应的KI溶液浓度越大,反应速率越快。
I2+2KOH,试用H2O2、KI溶液、淀粉溶液、水等药品,设计一个实验来说明与一定量H2O2反应的KI溶液浓度越大,反应速率越快。
下表所列数据是在某高温下金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
| 反应时间t/h |
1 |
4 |
9 |
16 |
25 |
| MgO层厚Y/nm |
0.05a |
0.20a |
0.45a |
0.80a |
1.25a |
| NiO层厚Y′/nm |
b |
2b |
3b |
4b |
5b |
注:a和b均为与温度有关的常数。
(1)金属高温氧化腐蚀速率可用金属氧化膜的生长速率来表示,其理由是_______________。
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系是_____________,_____________;MgO氧化膜膜厚Y属_____________型,NiO氧化膜膜厚Y′属_____________型(填“直线”或“抛物线”,“对数”或“双曲线”等类型)。
(3)Mg与Ni相比较,金属具_____________有更良好的耐高温氧化腐蚀性,其理由是______________________________________________________________________________。
(12分)温度对化学反应速率影响的实验探究根据下图所给出的仪器和药品进行实验。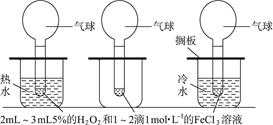
操作方法:在三支相同的试管中分别加入2 mL—3 mL约5%的H2O2,然后在每支试管中滴加2滴1 mol·L-1的FeCl3溶液后立即套上气球(大小相同)。等三支试管上的气球大小差不多相同时,同时置于三个烧杯中观察现象。
实验现象为___________________________________________________________________。
实验结论为___________________________________________________________________。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下
根据要求填空:
(1) B装置有三种功能:①_________________;②____________;③
________________________。
(2) 设 (Cl2)/
(Cl2)/  (CH4) =
(CH4) = ,若理论上欲获得最多的氯化氢,则
,若理论上欲获得最多的氯化氢,则 值的取值范围为___________。
值的取值范围为___________。
(3) D装置的石棉中均匀混有KI粉末,其作用是___________________。
(4)E装置的作用是_______________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)。
A.CH4 B.CH3Cl
C.CH2Cl2 D.CHCl3
E.CCl4
(10分)现欲分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的名称:
(1)写出各有关物质的名称:
| A._________________, | B._________________ | C._________________, | D._________________,E._________________。 |
(2)写出加入的试剂:
a._____________,b._____________。
(3)写出有关的操作方法:
①_____________,②_____________,③_____________。
(11分)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2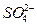
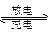 2PbSO4+2H2O
2PbSO4+2H2O
请完成下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是__________________;电解液中H2SO4的浓度将变__________________;当外电路通过1 mol电子时,理论上负极板的质量增加_________________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成_________________、B电极上生成_________________,此时铅蓄电池的正负极的极性将_________________。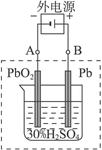
下图是测定植物的某一生命活动过程的实验装置。A瓶中NaOH溶液的作用是__________________________________________________________________________,B瓶中的石灰水的作用是___________________________________________,D瓶中出现的现象是___________________________________________。此实验说明植物具有_________性质。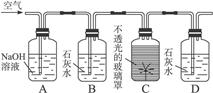
某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如下图象。请回答: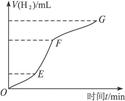
(1)分析判断,_____________段化学反应速度最快,原因可能是___________________;
FG段化学反应速率较慢的原因可能是____________________________________________。
(2)为了降低该反应的反应速率,你认为可以采取哪些措施_________________(至少说出两种)。
电子工业使用的印刷线路板,是在敷有铜膜的塑料板上以涂料保护所需的线路,然后用FeCl3的溶液与未受保护的铜膜反应以去掉铜,腐蚀后的废液中含有大量的Cu2+。为了回收这一部分Cu2+并制成硫酸铜晶体(CuSO4·5H2O),常用如下步骤:
①向废液中加过量的铁屑,搅拌,静置;②滤出固体物质;③将滤出的固体物质加热煅烧;④把煅烧后的物质放在硫酸中溶解;⑤调节溶液的pH在3.4—4之间,使Fe(OH)3沉淀完全,过滤;⑥浓缩滤液,析出晶体;⑦将过滤得到的晶体溶解,再结晶。
(1)上述③步操作所得煅烧产物成分是_______________。
A.CuO B.CuO和FeO C.CuO和Fe2O3 D.CuO和Fe3O4
(2)上述第⑤步操作中,调节溶液的pH宜加入的物质是_______________。
A.氧化铜粉末 B.NaOH溶液 C.稀氨水 D.Na2CO3
(3)上述第⑥步操作中,用浓缩滤液而不用蒸干溶液的主要原因是_______________。
A.蒸干所得到的物质可能含有无水硫酸铜
B.温度升高CuSO4溶解度增大
C.温度升高Cu2+被还原为Cu
D.温度升高CuSO4分解
现给你一试管二氧化氮,其他药品和仪器自选。试设计实验,要求尽可能多地使二氧化氮被水吸收。
| |
实验步骤 |
现象 |
解释(可用化学方程式表示) |
| (1) |
|
|
|
| (2) |
|
|
|
| (3) |
|
|
|
某学生做钠在氯气中燃烧的实验时,使用了崭新的铜制燃烧匙,当钠燃烧时,除了观察到有白烟外,还有少量棕色的烟,能说明这个现象的化学方程式为
__________________,___________________________;将上述反应得到的固体溶于水后再加入NaOH溶液,产生少量蓝色沉淀,该反应的离子方程式为:
__________________________。
吸烟对健康有害,科学实验表明:香烟所产生的烟雾中至少有300多种化合物对人体有不同的危害。为了鉴定该烟雾中是否存在CO2和CO,将香烟燃烧产物的烟雾进行适当处理后,依次通过足量以下试剂:①澄清石灰水;②浓硫酸;③灼热的黑色氧化铜粉末;④澄清石灰水。发现①④中澄清石灰水变浑浊,其他无明显现象。试完成下列问题:
(1)①中现象说明______________________________________________________________。
(2)烟雾中(填“存在”或“不存在”)CO,作出此判断所依据的实验现象为____________。
(3)③中无明显变化的原因可能是
_________________________________________________。
实验室配制500 mL 0.5 mol·L-1的稀硫酸溶液,有如下操作步骤:①把量取好的浓硫酸放入小烧杯中,加适量蒸馏水溶解;②把①所得溶液立即小心地转入500 mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度1—2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)应该量取____________________mL 18.4 mol·L-1浓硫酸。
(2)上述步骤中第___________步不恰当,正确的操作是:___________________________。
(3)实验操作步骤的正确顺序为(填序号):_______________________________。
(4)本实验用到的玻璃仪器有:__________________________________________。
(5)若出现如下情况,对所配溶液浓度将有何影响?没有进行操作④:________________。加蒸馏水时不慎超过了刻度:____________________。定容时俯视读数:______________。
(6)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度:______________。向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面:__________________。