用18mol/L的硫酸配制100mL 1.0mol/L硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号) 。
(2)在容量瓶的使用方法中,下列操作不正确的是 (填写标号)。
A.使用容量瓶前检查它是否漏水。
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗。
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线。
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线。
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次。
某种常见金属的部分性质如下:银白色固体,硬度较小,密度为2.70g/cm3,熔点为660.4℃,导电性、导热性、延展性良好。
(1)试推断该金属可能的一种用途______。
(2))请提出你想探究的有关该金属化学性质的两个问题:①______;②______。
(3)请设计实验方案对你所提出的两个问题进行探究(简述步骤、现象及结论):
①__________________________;②__________________________。
阅读下面三段材料:
①早在1785年,卡文迪许在测定空气组成时,除去空气中的O2、N2等已知气体后,发现最后总是留下一个体积不足总体积1/200 的小气泡。
②1892年,瑞利在测定氮气密度时,从空气中得到的氮气密度为1.2572g/L, 而从含氮化合物分解得到的氮气密度为1.2508g/L。两者相差0.0064g/L。
③瑞利和拉姆赛共同研究后认为:以上两个实验中的 “小误差”可能有某种必然的联系,并预测大气中含有某种较重的未知气体。经反复实验,他们终于发现了化学性质极不活泼的惰性气体——氩。
请回答下列问题:
(1)材料①、②中的“小误差”对测定空气组成和氮气密度的实验而言是主要因素还是次要因素?
(2)材料③中科学家抓住了“小误差”而获得重大发现说明了什么问题?
现有下列实验仪器:
(1)写出仪器名称:a是_____,g是_____。
(2)给仪器b中液体进行加热时,液体的体积不能超过其容积的_____。
(3)用上述仪器组装加热高锰酸钾制取氧气的装置时,不需要用到的仪器是(填序号)_____。
(4)用排水法收集氧气的过程中,判断集气瓶中氧气已经收集满的方法是_____。
由于条件所限,仅有一大一小两支试管和稀硫酸,甲、乙两同学各找来铝制牙膏皮,
各自设计一种装置来制取一试管氢气。他们设计装置如图所示:
(1)上述两装置相比,____________(填“甲”或“乙”)装置设计更合理。
(2)用较合理的装置来制取氢气,现欲使氢气充满收集气体的试管,应采取的措施
是__________________________。
(3)还可以用哪些物品代替牙膏皮或稀硫酸来完成反应?___________(填写一种物质即可)。
 1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且具有两性;E溶液的焰色反应中呈黄色火焰。回答以下问题:
(1)写出X的化学式:________,X属于________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:____________________ __________;
写出K与J反应的化学方程式:____________________________ _____。
|
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。 +2N2 4X+SiC+3C。
4X+SiC+3C。
(12分)在右图所示的实验装置中,A中盛有品红溶液,B中盛有NaOH溶液。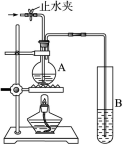 请回答下列问题:
请回答下列问题:
(1)若向A中通入足量的二氧化硫气体,A中的现象是______________________。
(2)若向A中通入足量的氯气后,再加热A,A中的溶液______(填“能”或“不能”)恢复到原来的颜色。
(3)如果A中盛的是氨水,B中盛的是无色酚酞溶液,微热A,B中溶液会变为红色,则此时表现氨水具有______性和______性。
(4)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和______性。
(5)如果A中盛的是盐酸,加入铜粉,为了让铜粉溶解,可以加入NaNO3,反应的离子方程式为:3Cu+2NO+8H+===3Cu2++2NO↑+4H2O,请用单线桥标出其电子转移的方向和数目。
(11分)某中学高一化学兴趣小组的同学,在实验室探究用过量的锌与浓硫酸反应制取SO2。
①这样制取的SO2中可能含有的杂质有________。
②某同学用下列装置连接成一整套实验装置以验证①的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是______→______→______→______→______→(用a、b……填写;每套装置只允许使用一次)。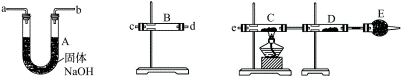
③根据②确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论填入下表:
| 装置 |
所盛药品 |
实验现象 |
结论 |
| B |
|
|
|
| C |
CuO固体 |
|
|
| D |
无水CuSO4 |
|
实验室利用右图所示装置制取乙酸异戊酯,其合成过程为: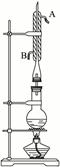
①向圆底烧瓶中加入几粒碎瓷片,并注入0.14mol异戊醇和0.35mol冰醋酸,再加入4 mL浓H2SO4至不再分层。
②在烧瓶上安装冷凝回流装置,加热混合物1小时后,冷却至室温。
③把混合物转至分液漏斗中,加少量蒸馏水,振荡分层后除去水层,再用蒸馏水洗涤有机层。
④用5%的NaHCO3溶液分几次洗涤产品直至中性。
⑤向上述溶液中加NaCl晶体,搅拌静置,对液体进行分液。
⑥将粗产品转至蒸馏烧瓶中,加入碎瓷片,并加适量无水MgSO4或Mg(NO3)2蒸馏,收集135 ℃—143 ℃之间的馏分。
试完成下列问题:
(1)冷凝管中冷却水流向是由_____________进入,由____________流出。(填“A”或“B”)
(2)圆底烧瓶中的物质_______________(填“会”或“不会”)从冷凝管上口跑掉,是因为
_____________________________________________________________________________。
(3)合成实验中浓H2SO4的作用是____________________________________________,碎瓷片的作用是__________________________________________________________________。
(4)乙酸与异戊醇的物质的量之比0.35∶0.14>1∶1的原因是_______________________。
(5)在③中用蒸馏水多次洗涤的作用是_______________________________________。④中用NaHCO3溶液洗涤产品的作用是________________________________________________。
某学生称取9g直链淀粉溶于水,测定淀粉水解的百分率,其程序如下:
淀粉溶液 混合液
混合液 混合液→
混合液→
(1)上述实验各步骤所加的试剂为A______________________,B _______________________,C _______________________。
(2)上述测定过程中,只加A溶液,不加B溶液是否可行,理由是___________________。
(3)当析出2.16g金属单质时,淀粉的水解率是___________________________________。
某学生设计了三种实验方案,用以检验淀粉的水解情况
方案甲:淀粉溶液 水解液
水解液 中和液
中和液 溶液变蓝。结论:淀粉完全没有水解。
溶液变蓝。结论:淀粉完全没有水解。
方案乙:淀粉溶液 水解液
水解液 无红色沉淀。结论:淀粉完全没有水解。
无红色沉淀。结论:淀粉完全没有水解。
方案丙:淀粉溶液 水解液
水解液 中和液
中和液 有红色沉淀。结论:淀粉已水解。
有红色沉淀。结论:淀粉已水解。
以上三种方案的设计及结论是否正确?如不正确,请简述理由。
右图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应时的步骤如下:
(1)在圆底烧瓶中装入7—8 g的氢氧化钠、5 mL硬脂酸甘油酯,然后加入2—3 g的水和10 mL的酒精,加入酒精的作用是________________________________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成。向所得混合物中加入
_________________,静置一段时间,溶液分成上下两层,肥皂在_________________层,此操作名称为_________________。
(3)图中长玻璃管的作用是___________________________________________________。
(4)写出该反应的化学方程式:_______________________________________________。
为证明草本灰的主要成分是K2CO3,设计如下实验:
(1)提取碳酸钾晶体,可供选择的实验操作步骤有:
| A.过滤; | B.溶解; | C.浓缩结晶; | D.蒸发;E.冷却结晶;F.萃取;G.蒸馏。按照操作顺序,应选择___________(写编号),在实验中都要用到的仪器是___________。 |
(2)鉴定提取的晶体是碳酸钾______________________________________________。
我国北方人的生活和取暖多以煤为燃料。
(1)燃煤对生态环境有何危害?
(2)烟气中有大量煤粉,人们用静电除尘器来消除烟气中的煤粉,并回收利用。如图为静电除尘器的原理示意图。它由金属管A和悬挂在管中的金属丝B组成。A接电源正极,B接电源负极,在AB间产生很强的电场,且距B越近场强越大,试判断除尘器工作原理的正确说法是( )
| A.烟气上升中,负极B使烟粉带负电,吸附到正极A上,在重力作用下,最后落入下边漏斗 |
| B.B极附近空气分子被电离,电子向正极运动过程中遇到煤粉使其带负电,吸附到正极A上,在重力作用下最后落入下边漏斗 |
| C.烟气上升中,煤粉在负极B附近被静电感应,使靠近正极A端带负电、引力较大,吸附到正极A上,在重力作用下最后落入下边漏斗 |
| D.烟气上升中,煤粉处在由A向B的强电场中被极化,在电场力作用下吸附到正极A上,在重力作用下,最后落入下边漏斗 |
(3)为了减少污染,提高利用率,现正兴起使用煤气,试用化学方程式表示其产生:_________________________
纯碱在日常生活和工业生产中用途广泛,需求量很大,因此纯碱的制备一直是科学家工作的一个重要方面。19世纪欧洲有个吕布兰制碱法,其主要反应原理是:
Na2SO4+2C Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3====CaS+Na2CO3
这种方法的最大缺点是:①此反应是高温固体反应,不能连续生产;②浪费原料,CO2不能回收利用;③污染环境,CaS没有任何用处,只能抛至野外。由于这些缺点的存在和后来化学工业的发展,吕布兰法被索尔维法代替。索尔维法的生产流程如下:
索尔维法能实现连续生产,但其食盐利用率只有75%,且所得副产品CaCl2没有用处,污染环境。
我国化学家侯德榜经过一年的努力,做了500多次循环实验,终于设计出新的制碱工艺,于1943年11月在完成实验室规模的流程实验基础上,在工厂顺利试产,食盐的利用率达96%以上,得到了纯碱和氯化铵两种重要产品。氯化铵主要用作氮肥。侯德榜制碱法原理是:
①在30~50 ℃的饱和食盐水中,先通入氨至饱和,再通入二氧化碳得到碳酸氢钠沉淀;
②过滤,将滤渣加热而得到产品;
③滤液中加入细食盐末,在10~15 ℃,使NH4Cl沉淀,滤液为饱和食盐水。
据此回答下列问题:
(1)标出反应Na2SO4+2C Na2S+2CO2↑的电子转移方向和数目。
Na2S+2CO2↑的电子转移方向和数目。
(2)写出索尔维制碱法的各步反应的化学反应方程式:
①_________________________
②_________________________
③_________________________
④_________________________
(3)写出侯德榜制碱法第①步反应的化学方程式_________________________
(4)在索尔维制碱法中____________物质可循环利用。
(5)在侯德榜制碱法中____________物质可循环利用。