如图所示,试管中集满干燥的氯气,胶头滴管中装有供反应的足量浓氨水。滴入浓氨水,开始时试管内发生的反应有氧化还原反应:NH3+Cl2→N2+HCl并产生红光和白烟。
请根据以上反应和现象回答下列问题:
(1)标志反应全部完成的现象是 。
(2)反应完毕后,将试管浸入水中并倒立着试管,取下滴管,有水进入试管.在室温时,进入试管内的水约占试管容积的 。
(3)反应中生成的白烟是 。
(4)用写出试管中反应的化学方程式 。
大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验。
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 作干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 ,该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
水蒸气通过灼热的煤所产生的混合气,其主要成分是CO、H2,还含有CO2和水蒸气,请用下图所示装置设计一个实验,以确认上述混合气中含有CO和H2。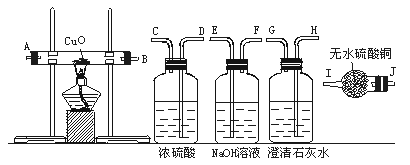
(1)连接上述装置的正确顺序是:(填接口字母)混合气→( ),( )接( ),( )接( ),( )接( ),( )接( ),( ).
(2)确认混合气中含有H2的实验现象是__________,其理由是_________________。
金币、银币、铜币等货币在我国历史上曾发挥过重要的作用。在一位收藏家的家中,陈列了很多金属货币。
(1)其中有些货币表面是黑色,且有少量的绿色锈状物,则这肯定是 币,黑色物质是 ,形成这种物质的化学方程式为 ,绿色物质是 ,形成这种物质的化学方程式为 。要除去这些物质应选用 ,发生反应的离子方程式为 ,充分反应后,这枚金属币的真面目为 色。
(2)其中一枚是闪闪发光的黄色金属币,它肯定是 币,表面一直未被氧化的原因是 。
(3)若将金币、银币、铜币分别放到稀硝酸中浸泡,能溶解的是 ,不溶解的是 ,写出溶解时的化学方程式 ,若想溶解不能被硝酸溶解的钱币,则选用 。
某科研小组,用含有少量的CaO和Fe2O3的高岭土(主要成分:Al2O3·2SiO2·2H2O)来研制新型净水剂,其实验方案如下:将土样和纯碱混合均匀,加热熔融,冷却后用水浸取熔块,过滤弃去残渣,滤液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即是净水剂。
(1)土样和纯碱混合均匀,加热熔融时,土样中的主要成分与纯碱反应的化学方程式为:
① ;②Al2O3+Na2CO3 2NaAlO2+CO2↑。
2NaAlO2+CO2↑。
(提示:NaAlO2易溶于水并转化为Na[Al (OH)4])
(2)最后得到的沉淀物是 ,生成沉淀的离子方程式为 。
(3)实验室中常备的坩埚有瓷坩埚,氧化铝坩埚和铁坩埚,本实验熔融土样时应选用 坩埚。
(1)有下列A~F六种试剂,它们的性质不同,选用的试剂瓶也不相同,请指出它们分别选用什么样的试剂瓶。
| A.二氧化硅 | B.硝酸银晶体 | C.氯水 | D.氢氟酸 E.浓H2SO4 F.NaOH溶液 |
(2)下列反应中,SiO2表现什么化学性质?
①SiO2+2NaOH=Na2SiO3+H2O;②SiO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑
③SiO2+2C Si(粗)+2CO↑;④SiO2+4HF=SiF4↑+2H2O
Si(粗)+2CO↑;④SiO2+4HF=SiF4↑+2H2O
如图所示装配好装置,待内外空气压强不变时标注出水银液面的刻度(用红漆),取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃迅速移入锥形瓶中并塞紧橡皮塞,硫粉安静地燃烧,水银柱推向左管,当火焰熄灭后,静置,水银柱又慢慢回到原标定的刻度。简要回答下列问题:
(1)水银柱推向左管说明什么?
(2)硫粉未燃尽时火焰就熄灭了。说明 。
(3)根据水银柱最后又回到原先标定的刻度。可得到什么结论?
(4)根据反应方程式S+O2=SO2和上述结论又可推导出什么(或证明什么)?
长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:
①称量ag样品,置于烧杯中。
②加入适量蒸馏水,使样品溶解。
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液。
④过滤,用蒸馏水洗涤沉淀。
⑤加热干燥沉淀物。
⑥将沉淀物冷却至室温后,称量。
⑦重复⑤、⑥操作直到合格,最后得到b g固体。
回答下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?__________;其理由是 。
(2)步骤③中加盐酸使溶液呈强酸性的目的是 。
(3)步骤⑦的“合格”标准是: 。
(4)实验测得样品中无水亚硫酸钠占原有样品的质量分数是 。(列出算式.不需化简)
根据下图回答问题:
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。答: 。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式: 。
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是 ,作用是 。
B中加入的试剂是 ,作用是 。
C中加入的试剂是 ,作用是除尽 气体。
D中加入的试剂是 ,作用是 。
(4)实验时,C中应观察到的现象是 。
亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀H2SO4、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有_____________,看到的现象是__________,反应的方程式为__________________________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_______________,看到的现象是________________,反应的方程式为_________。
研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
② 实验过程中,使用分液漏斗滴加浓硫酸的操作是 。
(2)将SO2气体分别通入下列溶液中:
① 品红溶液,现象是 ;
② 溴水溶液,现象是 ;
③ 硫化钠溶液,现象是 。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
① 原因 ,验证方法 。
② 原因 ,验证方法 。
③ 原因 ,验证方法 。
标准状况下,将1L可能含有N2,H2,CO,NH3,NO2,H2S杂质的无色SO2气体,依次通过如下图所示的装置。(各容器中液体均为足量)
其变化情况是:①气体通过A瓶,浓H2SO4无明显变化,气体体积无变化;②气体通过B瓶,饱和Na2CO3溶液质量增加0.5g,气体体积无变化;③气体通过C瓶后,再通过D管,灼热的CuO中有红色物质生成。冷却后,气体体积变为888ml(标准状况);④将上述气体通过E后,再通入F中,澄清石灰水变浑浊,同时增重1.54g;⑤气体经过干燥管P后,在量筒H中,收集到水104ml。根据以上实验回答:
(1)混合气体中SO2的体积分数为______________。
(2)混合气体中含有的杂质为______________。
(3)混合气体中是否含有H2、CO杂质;若有,指出其体积;若无,说明理由。
a.H2:____________________________________________________________________;
b.CO: ____________________________________________________________________。
A~H等8种物质存在如下转化关系(反应条件,部分产物未标出)。已知:A是正盐, B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:
(1)写出下列物质的化学式:A ,B ,C 。
(2)写出下列反应的化学方程式:
E→F ;
G→H ;
D的浓溶液与木炭反应的方程式: 。
(3)检验某溶液中是否含D中阴离子的方法是 。