硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、硬质玻璃管常作为气体和固体反应的场所,如图(其他装置省略,必要时可加热)。
下列实验描述不正确的是
| A.固体A为无水硫酸铜时,可以检验气体X中是否含有水蒸气 |
| B.固体A为铜时,可以除去N2中的O2 |
| C.在空气流作用下,加热氯化铁晶体得到纯净的无水氯化铁 |
| D.将氨气和空气混合气通过灼热的铂丝,可看到有红棕色气体生成 |
Ⅱ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,
a、b、c三个棉球变化如下表。请填写表中的空白:
| 棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
| a |
棉球变白,微热后又恢复红色 |
||
| b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式: |
| c |
棉球变为白色 |
结论:该气体具有性 |
(1)利用化学反应可以制备许多物质。实验室用铜制备NO2的离子方程式为___________________。
(2)工业上,黄铜矿(主要成分CuFeS2)是提取铜的主要原料,可采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:Cu2S+2Cu2O===6Cu+SO2↑。该反应中还原剂为_______ (填化学式),每生成1mol Cu,反应中转移电子的物质的量为___________。
黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。 ②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
a.通过上述②,炉渣中的Al2O3变成了(写离子)。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸稀硫酸 KSCN溶液酸性KMnO4溶液 NaOH溶液碘水
所选试剂为。
证明炉渣中含有FeO的实验现象为。
随着科学的发展,科学家们合成了一些氙的化合物。请回答下列问题。
(1)Xe原子的价电子排布式为_________。稀有气体中只有密度较大的氙能合成出多种化合物,其原因是____________。
A.氙含量比较丰富B.氙原子半径大,电离能小C.氙原子半径小,电离能大
(2)研究报告指出:“关于XePtF6”的化合价有 、
、 两种可能,经证实
两种可能,经证实 不溶于
不溶于 等非极性溶剂。”据此可确定
等非极性溶剂。”据此可确定 中化学键类型为________。
中化学键类型为________。
(3)金属 采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
已知金属Pt的密度为 则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
(4)氙的含氧化合物主要有 和
和 ,它们都有很强的氧化性,
,它们都有很强的氧化性, 的分子构型是__________,
的分子构型是__________, 中Xe原子的杂化类型是_______,与
中Xe原子的杂化类型是_______,与 分子互为等电子体的离子有___________(填一种)。
分子互为等电子体的离子有___________(填一种)。
焦亚硫酸钠( )常用作食品漂白剂,其制备工艺流程如下:
)常用作食品漂白剂,其制备工艺流程如下:
已知:反应Ⅱ包含 等多步反应。
等多步反应。
(1)反应Ⅰ的化学方程式为____________,反应Ⅰ进行时应先通入__________气体。
(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,目的是__________。在上述工艺流程中可循环使用的物质是_____________。
(3)反应Ⅱ中需控制参加反应的气体与固体的物质的量之比接近____________,若气体量不足,则会导致_______________。
(4) 与稀硫酸反应放出
与稀硫酸反应放出 ,其离子方程式为___________。
,其离子方程式为___________。
铝是一种应用广泛的金属,工业上用 和冰晶石(
和冰晶石( )混合熔融电解制得。
)混合熔融电解制得。
①铝土矿的主要成分是 和
和 等。从铝土矿中提炼
等。从铝土矿中提炼 的流程如下:
的流程如下:
②以萤石( )和纯碱为原料制备冰晶石的流程如下:
)和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1)写出反应1的化学方程式_________________________、________________________________;
(2)滤液Ⅰ中加入 生成的沉淀是___________,反应2的离子方程式为____ ___________________
生成的沉淀是___________,反应2的离子方程式为____ ___________________
(3)E常用作制作豆腐的添加剂,化合物C是____,写出由D制备冰晶石的化学方程式_______________;
X、Y是短周期同主族元素,Z是过渡元素,化合物 、
、 可发生如下转化。
可发生如下转化。
(1)X的元素符号为_________, 的化学式为_________。
的化学式为_________。
(2)蓝色溶液中含有的阴离子是_______________。
(3)过程②中发生反应的离子方程式为_______________。
A、B、C、D、E是中学常见的几种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
回答下列问题:
(1)X的单质与A反应的化学方程式是________________________________。
(2)若C溶液显碱性,则试剂1是 ____溶液(写化学式);若C溶液显酸性,则显酸性的原因是(用离子方程式表示)。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是;
②写出D→E反应的离子方程式;
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是:。
某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 |
实验现象 |
| ①将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
| ②反应结束后分离出溶液备用。 |
|
| ③红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]。 |
按实验中发生反应的现象写出下列化学方程式(是离子反应的只写离子方程式)
①析出疏松的红色固体;
③一段时间后固体由红色变为绿色。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是。
解释此现象的离子方程式是、。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)
。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是。
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素的原子结构示意图为。
②该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为。
(2)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用化学方程式表明B溶液呈碱性的原因。
②自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
某些化学反应可表示为:A+B→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,则该反应离子方程式为____________________________________________________。
(2)若A为黑色固体,C是黄绿色气体,则该反应的化学方程式为______________________。
(3)若C为NaCl,D是能使澄清石灰水变浑浊的无色无味的气体,若A为盐,B为酸,则A是___________________或___________________ (填化学式)。
(4)若A是铁的一种氧化物,B是盐酸,则A与B反应的化学方程式为___________________。
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示:
| T/℃ |
20 |
40 |
60 |
80 |
 (Li2CO3)/g (Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
 (Li2SO4)/g (Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
③从滤渣1中提取出Si的部分流程如下图所示:
根据以上信息,请回答下列问题:
(1)括号内应提供的相应条件和物质 、 。
(2)方框中所得物质的化学式 。
(3)使用浓硫酸并加热到250℃~300℃的目的是 。
(4)②处加Na2CO3溶液所发生反应的离子方程式 、 。
(5)滤渣2的主要成分有 。
(6)如何检验Li2CO3是否洗涤干净? 。
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SiO32-、SO42-、NO3-中的一种或几种离子。为确定溶液X的成分,进行如下实验:
根据以上信息,请回答下列问题:
(1)溶液X中肯定不含有的离子是,不能确定是否含有的离子是,若要确定是否含有这种离子,最可靠方法是:
。
(2)溶液I中所含溶质有(填化学式)。
(3)步骤①②③④中,发生符合“强酸制弱酸”反应的步骤是(填序号)。
(4)步骤①中生成气体A的离子方程式是。
W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。
(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
| A.M、X、Z形成的单质熔沸点 M>X>Z |
| B.氢化物的热稳定性:W>X |
| C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同 |
| D.Z元素含氧酸的酸性一定强于Y元素的含氧酸 |
(3)元素W与M按原子个数比1:1形成的化合物A的电子式为______________。
(4)X、Z与氢三种元素按1:2:2形成的五原子化合物属于_______分子(填 “极性” “非极性”)
(5)与Z同族的元素都能形成氢化物,其中水溶性最强的是______(填化学式)
(6)含有N元素的两种常见离子能发生双水解反应,试写出该离子方程式 ________________。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: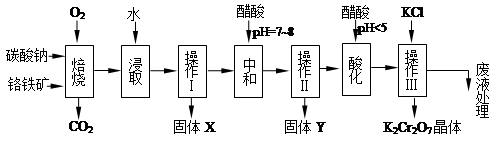
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
根据题意回答下列问题:
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、、过滤、_______、干燥。
(4)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl →K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
| 物质 |
溶解度/(g/100g水) |
||
| 0°C |
40°C |
80°C |
|
| KCl |
28 |
40.1 |
51.3 |
| NaCl |
35.7 |
36.4 |
38 |
| K2Cr2O7 |
4.7 |
26.3 |
73 |
| Na2Cr2O7 |
163 |
215 |
376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、……灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_______(用含m、n的代数式表示)。
(6)六价铬有毒,而Cr3+相对安全。工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3。在实验室中模拟这一过程的装置如下: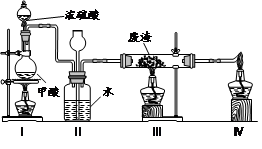
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是_________________________。
已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。步骤一:电解精制:
请回答以下问题:电解时,阴极上的电极反应式为;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程:
则100ml滤液中Fe2+的浓度为mol·L-1