已知:Fe2+能被稀硝酸氧化,反应方程式为:3Fe(NO3)2+4HNO3(稀)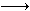 3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
| 硝酸体积(mL) |
100 |
200 |
300 |
400 |
| 剩余固体(g) |
18.0 |
9.6 |
0 |
0 |
| 放出气体的体积(mL) |
2240 |
4480 |
6720 |
(1)由NO与HNO3的关系可知,稀硝酸的物质的量浓度为_______ mol·L-1。
(2)稀硝酸的密度为__________g/cm3。
(3)放出2240 mL气体时,反应的离子方程式是_____________________________,放出4480 mL气体时,消耗金属的质量为_______g。
(4)原混合物中铁和铜的物质的量比为__________。
(5)加入400 mL稀硝酸,反应完全后,溶液中NO3-的物质的量为________mol。
(6)当溶液中Cu2+、Fe2+的物质的量浓度相等时,放出气体的体积_________mL(标准状况下)。
短周
 期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化:
①丁与乙和水反应生成戊和丙的离子方程式为,由物质已电解得到单质D的化学方程式为;
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为。
(2)已知E及其化合物有以下变化:
写出单质E与化合物Z在一定条件下反应生成.X和水的化学方程式。
由A、B、C、D、E5种元素中的.两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为____(任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留, 所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是。
所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2(g) + O2(g)= 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g)= 2CO2(g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式。
(3)在25℃下,向浓度均为0.1 mol・L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学 式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为 中性,则Va︰Vb=。
中性,则Va︰Vb=。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
(7)NH4Cl是一种重要的化肥。
①用0.1 mol·L—1的盐酸滴定0.1 mol·L—1的氨水,滴定过程中不可能出现的结果是:
a.
b.
c.
d.
②NH4Cl溶液中存在:NH4+ + H2O NH3·H2O + H+,则该反应常温下的平衡常数K=(已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
NH3·H2O + H+,则该反应常温下的平衡常数K=(已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分别属于不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M常作为耐火材料。请回答下列问题:
(1)W原子L层电子排 布式为, W3空间构形是
布式为, W3空间构形是 。
。
(2)X单质与水反应的主要化学方程式。
(3)化合物M的化学式,将一定是的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂酸醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有,O-C-O的键角约。
(4) X、Y、Z可形成立方晶体的化合物,其晶胞中X占有棱的中心,Y位于顶角,Z位于体心位置,则该晶体的组成为X:Y:Z=。
(5)含有元素Z的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是。
I、二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl更好。
⑴在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是。
⑵用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。
饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I—还原为ClO2—、Cl—的转化
率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2—也能被I—完全还原为Cl—。反应生成
的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
①请写出pH≤2 .0时ClO2—与I—反应的离子方程式。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3
溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根据上述分析数据,测得该饮用水中ClO2—的浓度为mol·L-1(用含字母的代数式表示)。
II.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差 ,工业上用湿法制备高铁酸钾的基本流程如下图所示:
,工业上用湿法制备高铁酸钾的基本流程如下图所示:
⑴在农业生产中,滤液1可用作。
⑵流程中生成高铁酸钾的离子方程式是:,控制此反应温度30℃以下的原因是: 。
。
⑶结晶过程中加入浓KOH溶液的作用是:。
⑷某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为。
⑸实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在附近、反应时间应控制在。
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为。
(2)As2S3和HNO3有如下反应,As2S3+10H++ 10NO3—="2H3AsO4+" 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为。若将该反应设计成一原电池,则NO2应该在(填“正极”或“负极”)附近逸出。
(3)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量(选填编号)。
a.小于0.5 mol b.等于0.5mol c.大于0.5mol d.无法确定
金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
请回答下列问题:(1)环戊二烯分子中最多有____ ________个原子共平面;
________个原子共平面;
(2)金刚烷的分子式为_______________,其分子中的CH2基团有_____________个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
其中,反应②的反应试剂和反应条件_____________,反应③的反应类型是___________;
(4)A是二聚环 戊二烯的同分异构体,A分子结构中有一个甲基,A能使溴的四氯化碳溶液褪色,
戊二烯的同分异构体,A分子结构中有一个甲基,A能使溴的四氯化碳溶液褪色, A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸【提示:苯环上的烷基(一CH3,一CH2R,一CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基】,写出A所有可能的结构简式(不考虑立体异构):
A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸【提示:苯环上的烷基(一CH3,一CH2R,一CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基】,写出A所有可能的结构简式(不考虑立体异构):
图表法、图象法是常用的科学研究方法。
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A |
B[ |
C |
D |
E |
F |
G |
H |
I |
J |
| 原子半径(10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
| 最高价态 |
+6 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
| 最低价态 |
-2 |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-4 |
试回答下列问题:
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是:(填编号)。比元素B原子序数大10的元素其基态原子的核外电子排布是 。
。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是(写分子式,写出一种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形
成 个σ键,个π键。
个σ键,个π键。
(4)短周期某主族元素K的电离能情况如图(A)所示。
则K元素位于周期表的第族。
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第族元素氢化物的沸点的变化规律。
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是,理由是
随着人们日常生活水平的提高,室内空气污染越来越受到人们的重视。造成室内环境污染的有毒物质主要有甲醛、苯、氨、氡、一氧化碳等物质。
请回答下列问题:
⑴苯分子的结构简式为。
⑵我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。某校化学研究性学习小组的同学通过查阅资料,拟采用如下方法测定某新装修居室内空气中甲醛的含量。
测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O
实验操作:用容积为1000mL的医用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置如下),当酸性高锰酸钾溶液正好褪色时,停止注入。
①用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液1000mL,需0.1000mol/L的酸性KMnO4溶液的体积为。
②向酸性高锰酸钾溶液中注入空气前,应检查吸收器装置气密性,操作方法为;装置中多孔玻璃球的作用是。
③实验时在居室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第200次将注射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液正好褪色。请通过计算说明该居室空气中甲醛含量是否超标(空气中其他成分不与酸性高锰酸钾溶液反应)。
④请你举出减少室内空气污染的一条合理措施:。
一定温度下,分别往容积均为5L的甲(恒容容器)、乙(恒压容器)中加入0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到2s时,测得甲容器中N2O4的浓度为0.09mol/L。经过60s,甲容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
(1)容器中气体出现红棕色的原因(用化学方程式表示)
________________________________________________;
(2) 达到平衡时,乙容器中反应所需的时间______60s(填“>”、“<”或“=”,以下同);容器内N2O4的浓度甲__________乙;反应过程中吸收的能量甲_________乙。
(3)若要使甲、乙中N2O4的浓度相等,不能采取的措施是__________(填选项的标号)
A.保持温度不变,适当缩小乙容器的体积
B.保持容器体积不变,使乙容器升温
C.保持容器体积和温度不变,向乙容器中加入适量N2O4
X、Z、Q、R 4种短周期元素原子序数的依次增大,Y是一种短周期主族非金属元素。化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol·L-1甲溶液的pH=13。工业上常用电解QR饱和溶液生产甲。请填写下列空白。
(1)Q的原子结构示意图为。
(2)电解QR饱和溶液反应的离子方程式为。
(3)常温下将R的单质通入甲溶液中,发生反应的离子方程式为。
(4)①若Y与X组成的气体化合物乙在常温下遇XR气体时产生白烟,则乙的化学式为;YZ2与水反应的化学方程式:________________________________________
②若Y元素的单质能发生如图所示转化,则Y元素名称是。YZ2的结构式为:_____________YZ2通过置换反应可生成Y的单质,该反应式为:____________________________________
③若Y元素的单质是一种淡黄色固体。写出Y的最高价氧化物的水化物的浓溶液与铜共热的化学方程式:______________ ____________________________________
④若Y的最高价氧化物可制光导纤维。写出工业生产Y单质的反应的化学方程式:____________________________________________________________
A~H有如图所示的转化关系,其中A是盐,B、C、D、E、F在常温常压下均是气态物质,反应④、⑤均在溶液中进行,转化中反应条件略去。
试回答下列问题:
(1)物质A的化学式为,电解时阴极反应式为.
(2)反应③的化学方程式为。
(3)反应⑤的离子方程式为。
(4)镁与铝能形成多种合金,为了确定某合金样品的成分,小明同学设计如图所示的实验步骤,确定合金组成。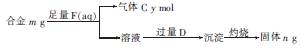
①能确定合金组成的数据组有(填字母)。
a.m、n b.m、y c.n、y
②若合金中Mg的物质的量分数为x,金属总物质的量为7 mol,试在图中作出y随x变化的曲线。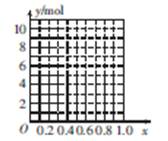
【化学——选修3:物质结构与性质】
在A、B、C三种元素中,A元素原子的价电子排布为2s22p5,B元素K、L能层上的电子数与M、N层上的电子数相同。C元素的原子序数等于A、B两元素原子序数之和,C的单质在生产生活中具有许多用途,它可在硫酸铜溶液中用电解法进行精炼。请回答以下问题:
(1)已知C元素的电负性数值为1.9,则A、C两元素的原子之间应形成键(填“共价”或“离子”);
(2)C元素的价电子排布式为____;
(3)在A元素氢化物的水溶液中,存在有种不同类型的氢键;
(4)SO42—中S原子的杂化轨道类型是____,SO42—的立体构型是____;
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(6)在A、B两元素所形成晶体的晶胞中,位于六面体顶点 和面心上的元素为(填具体的元素符号)。
和面心上的元素为(填具体的元素符号)。
炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。
试回答下列问题:
(1)“浸出”时用到的“试剂X”为(填名称)。
(2)写出“氧化”过程的离子方程式。
(3)“调pH”过程可以选用。(从以下选项选择, 填序号)
A.H2SO4 B.ZnO C.NaOH
“滤渣2”的主要成分是(填化学式,下同)。
(4)“试剂Y”是______________;“滤渣3”的成分为______________________。
(5)“操作1”的方法是___ ____;在“操作1”时,必须采取的实验措施是。
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。
实验步骤:将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
(1)可以判断该分解反应已经达到化学平衡的是___________。
A. |
B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
(2)根据表中数据,计算25.0℃时的分解平衡常数:__________________________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。