填写下列空格
(1) 名称是 ;
名称是 ;
(2) 名称为 ,1mol该烃完全燃烧需消耗氧气 mol。
名称为 ,1mol该烃完全燃烧需消耗氧气 mol。
(3) 将CH4的四个氢原子相互连接可以构成一个正四面体。如右图是一个正方体,设想将一个甲烷分子放入,碳原子将位于该正方体的中心,黑球表示已有一个氢原子属该正方体的一角。请在图中另画三个黑球表示其他3个氢原子的位置。
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。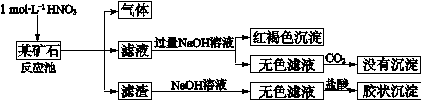
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
| a.酸性:H2CO3>H2SiO3 |
b.原子半径:O<C<Si<Al |
| c.稳定性:H2O>CH4>SiH4 |
d.离子半径:O2-<Al3+ |
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 |
含量/(mg L-1) |
成分 |
含量/(mg L-1) |
| Cl- |
18980 |
Ca2+ |
400 |
| Na+ |
10560 |
HCO3- |
142 |
| SO42- |
2560 |
Br- |
64 |
| Mg2+ |
1272 |
|
|
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。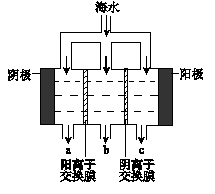
①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:
①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离
子方程式是 。用平衡移动原理解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。
常温下,将0.1000 mol L-1 NaOH溶液滴入20.00 mL 0.1000 mol L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示。
(1)HA与NaOH溶液反应的离子方程式是 。
(2)图中②点所示溶液中,下列粒子的浓度关系正确的是 (填序号)。
a.2c(Na+)= c(HA)+c(A-)
b.c(Na+)+c(H+)=c(A-)+c(OH-)
c.c(Na+)>c(A-)>c(H+)>c(OH-)
(3)图中③点所示滴入的NaOH溶液的体积V 20.00 mL(填“>”、“<”或“=”)。
(Ⅰ)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g) 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
| 温度/℃ |
1538 |
1760 |
2404 |
| 平衡常数K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
该反应的△H 0。(填“>”、“=”或“<”)
(3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应N2(g)+O2(g)  2NO(g)达到平衡时NO的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
(Ⅱ)(5分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
(1)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(2)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为 反应(填吸热或放热)
(3)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
在一定温度下,向一2L固定容积的密闭容器中通入20 molN2和60 molH2,经过5分钟后,N2的浓度是5mol∕L,又过了5分钟 N2、H2、NH3的浓度不再变化,此时NH3的浓度是14 mol∕L,达到平衡后共放出QKJ的热量,试完成下列问题:
⑴前5分钟用H2表示的化学反应速率( );
⑵反应达到平衡后N2的转化率( );
⑶表示该温度下合成氨的化学平衡常数的表达式为( );
⑷若平衡后再增大压强,化学平衡向( )方向移动(填“正”“逆”“不”);
⑸该温度下反应的热化学方和式为( )(用含Q的式子表示);
⑹在该温度下,向另一2L固定容积的密闭容器中通入N2 5 mol、H215 mol、NH330 mol,反应达到平衡后H2的浓度是( )。
下图转化关系中A—H为中学化学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)
(1)写出下列物质的化学式:A________ F________ 甲_______ 丙________ .
(2)按要求完成下列反应:
A与B反应的化学方程式 ____________________________________;
丙与D溶液反应的离子方程式_________________________________。
(3)鉴别B和F的方法_____________________________________________。
某化学兴趣小组在课外活动中,对某溶液进行了三次检验,每次检验结果如下表所示,请回答下列问题。
| 检验次数 |
溶液中检验出的物质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NH4Cl |
| 第二次 |
BaCl2、Na2SO4、K2CO3、NH4Cl |
| 第三次 |
NaCl、Na2SO4、K2CO3、NH4Cl |
(1)三次检验结果中第 次检验结果不正确。
(2)检验时,为了证明溶液中存在SO42-、Cl-、CO32-,取一份溶液,进行下列实验:
第一步:向溶液中滴加过量的 (填化学式)溶液,其目的是 ;
第二步:向溶液中滴加过量的 (填化学式)溶液,其目的是 ;
第三步:过滤,再向滤液中加入少量的 (填化学式)溶液,其目的是 ;
(3)为了确定 NH4+的存在,写出鉴定NH4+的实验方法和现象: 。
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。 
(1)若X是空气中存在的强氧化性无色气体单质,则A可能是___________(填序号)
a.C b.Na c.S d.Al
(2)若X是日常生活中最常用的金属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
B的化学式为____________;反应②的化学方程式为: ,
C溶液中加入NaOH溶液后产生的现象是 , 方程式为 。
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应 N2(g
N2(g )+O2(g)
)+O2(g) 2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
| 温度/℃ |
1538 |
1760 |
2404 |
| 平衡常数K |
0、86×10-4 |
2、6×10-4 |
64×10-4 |
①该反应的△H 0(填“>”、“=”或“<”)。
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,
请补充完成1760℃时N2的转化率随时间变化的示意图。
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方 程式如下:
程式如下:
2N2(g)+6H2O(1) =4NH3 (g)+3O2(g) △H=+1530kJ·mol-1
(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g) =4NO(g)+6H2O(1) 的反应热△H= 。
(用含a的代数式表示)
(3)最近一些科学家 研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2
研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2 2NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
2NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
 (4)合成氨的反应N2(g)+3H2(g)
(4)合成氨的反应N2(g)+3H2(g) 2NH3(g) △H = -92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H = -92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a、升高温度 b、加入催化剂 c、增加H2的浓度
d、增加N2的浓度 e、分离出NH3  (5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”),可推断a 0、01(填大于、等于或小于)。
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”),可推断a 0、01(填大于、等于或小于)。
如图所示3套实验装置,分别回答下列问题: (1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放100 mL 0、2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0、5 mol/L的CuSO4溶液。反应一段时间后,停止通电。取出Cu电极,洗涤、干燥、称量、电极增重 0、64 g。
①电源的M端为 极,甲烧杯中铁电极的电极反应为 ;
②乙烧杯中电解反应的离子方程式为 ;
③甲、乙两烧杯中生成的气体标准状况下共 mL。
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
| 原子半径(10-10m) |
1、02 |
2、27 |
0、74 |
1、43 |
0、77 |
1、10 |
0、99 |
1、86 |
0、75 |
1、17 |
| 最高价态 |
+6 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
| 最低价态 |
-2 |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-4 |
试回答下列问题:
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是: 。(写元素符号)。比元素B原子序数大10的元素其基态原子的核外电子排布式是 。
(2)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形成 个σ键, 个π键。
(3)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第 族。
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
②不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是 ,理由是 。
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是 ,电极名称是 ,N的电极反应式为 ,通入乙醇的铂电极的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为 。
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为 。
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。
②反应2NO2(g)  N2O4(g)在b点的平衡常数K(b)= 。
N2O4(g)在b点的平衡常数K(b)= 。
③反应2NO2(g)  N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
K(d) K(b)(填“>”、“=”或“<”)。
(3)①据图分析,在25 min时采取的措施是 (填序号)。
| A.加入催化剂 | B.缩小容器体积 |
| C.加入一定量的NO2 | D.加入一定量的N2O4 |
②若在35 min时,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是
在25 ℃时,用石墨电极电解2.0 L,2.5 mol/LCuSO4溶液。5 min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题:
(1) 极发生氧化反应(填阴,阳),电极反应式为 。
(2) 极发生还原反应(填阴,阳),电极反应式为 。
(3)有 mol电子发生转移,得到氧气的体积(标准状况)是 L ,溶液的pH是 。反应速率v(Cu2+):v(O2)==
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 g ,电解液的pH (填“变小”、“变大”或“不变”)