[化学——选修2:化学与技术]氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系, 在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)步骤①中得到的氧化产物是 。溶解温度应控制在60~70℃,原因是 。
(2)写出步骤③中主要反应的离子方程式 。
(3)步骤⑤包括用pH = 2的酸洗、水洗两步操作,酸洗采用的酸是__________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有 (填字母)。
A.分馏塔 8.离心机 C.反应釜 D.框式压滤机
(6)准确称取所制备的氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+。样品中CuCl的质量分数为 。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
 ClO3-+
ClO3-+ Fe2++
Fe2++ =
= Cl-+
Cl-+ Fe3++
Fe3++ .
.
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+——K1
Fe(OH)2++H+——K1
Fe(OH)2++H2O Fe(OH)2++H+——K2
Fe(OH)2++H+——K2
Fe(OH)2++H2O Fe(OH)3+H+——K3
Fe(OH)3+H+——K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
(4)FeCl3也可以用作SO2尾气的吸收剂,原理上与NaOH吸收SO2有何不同______________________
(5)电解时,微粒的放电顺序遵循微粒得失电子能力的强弱,SO32—具有强的还原性。用NaOH吸收烟气中的SO2,将所得的Na2SO3溶液用碳棒进行电解,写出阳极电极反应_____________________________
在固定容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:

(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 。反应的平衡常数K1= 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②100℃时达到平衡后,向容器中再充入0.20mol NO2气体,新平衡建立后,NO2的体积分数
(填“增大”、“不变”或“减小”)
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
(本题共14分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
① 写出该反应的化学方程式 .若反应中生成0.15 mol HNO3,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3,F2,NO三种气体中,氧化性由强到弱的顺序为
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有__________________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
【物质结构与性质】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材 料。回答下列问题:
(1)基态铜原子的电子排布式为 ;已知高温下CuO—→Cu2O+O2,试从铜原子价层电子结构变化角度解释这一反应发生的原因: 。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ,若“Si-H”中键合电子偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为__ __。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3.NH3,BF3.NH3中B原子的杂化轨道类型为_______________,B与N之间形成 键。
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 ,在SiC中,每个C原子周围最近的C原子数目为 ,若晶胞的边长为a pm,则金刚砂的密度为 。

【化学与技术】粗铜精炼后的阳极泥含有Cu、Au(金)、Pb和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e一=Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为__ __过滤、洗涤、干燥,操作II的名称是 。
(4)写出用SO2还原AuCl4一的离子方程式__ __。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液l并入硫酸铜溶液进行循环操作,请指出 流程图中另一处类似的做法___________________。
(6)已知常温时,Ksp(PbCO3)=l.46xl0-13,Ksp(PbSO4)= 1.82xl0-8,用离子方程式表示加入碳酸钠溶液的作用___________________。
在1.0L密闭容器中放入l.0molX(g),在一定温度进行如下反应:
X(g) Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:

回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H__________0(填>、<或=)
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是__________。
| A.缩小容器容积 | B.及时分离出Y、Z | C.使用合理的催化剂 | D.升高体系温度 |
(3)计算平衡时X的转化率为__________,该温度下反应的平衡常数值为:___________。
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=__ mol,n(X)=__ mol,反应物X的转化率a(X)的表达式为__________。
坐落在山东沿海地区的潍坊纯碱厂是我国重点大型企业,其生产工艺沿用我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:

①上述生产纯碱的方法称 ,副产品的一种用途为 。
②沉淀池中发生的化学反应方程式是 。
③写出上述流程中X物质的分子式 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:

(1)原NaOH溶液的物质的量浓度为______________。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________ ,其物质的量之比为________________。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为_______ mL。
【化学—选修2:化学与技术】生态工业园区的建设,不仅仅是体现环保理念更要依据循环经济理论和充分考虑经济的可持续发展。下面是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产三大生态产业链流程图。

根据上述产业流程回答下列问题:
(1)从原料、能源、交通角度考虑该企业应建在
| A.西部山区 | B.沿海地区 | C.发达城市 | D.东北内陆 |
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式① ,② ,③ ,④ ,⑤ 。
(3)沸腾炉发生反应的化学方程式 ,磷肥厂的产品是普钙,其主要成份是 (填化学式)。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据生态园区建设理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想 , (请写出两点)。
(10分)如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理。B在实验时才插入溶液中。
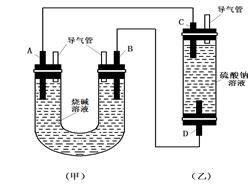
(1)从装置的特点判断,甲、乙装置中 是原电池,其负极的电极反应式为: ;
(2)实验开始后,(乙)装置中有关电极反应是:C: ;D: ,D电极上的现象是 ,一段时间后溶液中的现象是 ;
(3)在实验(2)的基础上,改变两装置电极的连接方式,A接D、B接C,此时D极上发生的电极反应式为: ,乙装置里除两电极上有明显的现象外,还可以看到的现象是 ,产生该现象的化学反应方程式是 。
(10分)有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比为2∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO2+O2 2SO3,并达到平衡。
2SO3,并达到平衡。
(1) 达到平衡所需时间,A容器比B容器___________,两容器中SO2的转化率A比B______________。
(2) 达到(1)所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡____________移动。
(3) 达到(1)所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数________________,B容器中SO3的体积分数__________________(填变大、变小、不变)。
【化学—选修2:化学与技术】南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水。
(1)硬水是指含有较多______________的水,硬水加热后产生沉淀的离子方程式为:_____________(写出生成一种沉淀物的即可)。
(2)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO),已知水的硬度在8°以下的软水,在8°以上的称为硬水。已知岛上山泉水中c( Ca2+)=1.2×10-3 mol/L,c(Mg2+) =6×l0-4 mol/L,那么此水 (填“是”或“否”)属于硬水。
(3)离子交换法是软化水的常用方法。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 。
(4)解放军战士通常向水中加入明矾净水,请用离子方程式解释其净水原理: 。
(5)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:

①阳离子交换膜是指 (填A或B)。
②写出通电后阳极区的电极反应式 ,阴极区的现象是: 。
利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g) N2O3(g),其平衡常数表达式为K=
N2O3(g),其平衡常数表达式为K=
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是 ;滤渣可循环利用,滤渣的主要成分是 (填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1:1,写出该工艺的化学反应方程式 ;若n(NO) :n(NO2)>1:1,则会导致 ;若n(NO) :n(NO2)<1:1,则会导致 。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式 。
进入秋冬季节后,郑州市频现雾霾天气,给人们的出行带来极大的不便和危害,人们“谈霾色变”。目前郑州市汽车保有量达230万量,汽车尾气的污染是引起雾霾的主要因素之一,NO和CO是汽车尾气的主要污染物。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)  SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
(2)某科研机构设计传感器检测CO的含量,其工作原理示意图如下:

Pt电极上发生的是 反应(填“氧化”或“还原”);写出NiO电极的电极反应式
(3)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,用化学方程式表示其原理