氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气的燃烧热值高,H2(g) +1/2 O2 (g) = H2O (g) ΔH = -241.8 kJ·mol-1
| 化学键 |
H-H |
O=O |
O-H |
| 键能(kJ·mol-1) |
X |
496.4 |
463 |
请根据相关数据计算:H-H的键能X = ________kJ·mol-1。
(2)根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:
CO2 (g) +3H2(g) H2O(l) + CH3OH(g) ΔH = -49.00 kJ·mol-1
H2O(l) + CH3OH(g) ΔH = -49.00 kJ·mol-1
一定温度下,在体积为1 L的密闭容器中充入1.00 mol CO2和3.00 mol H2,测得CO2和CH3OH的浓度随时间变化如图所示。

①能说明该反应已达平衡状态的是________(填代号)。
A.CO2在混合气体中的体积分数保持不变
B.单位时间内每消耗1.2 mol H2,同时生成0.4 mol H2O
C.反应中H2O与CH3OH的物质的量浓度比为1:1,且保持不变
②从反应开始到平衡时的平均反应速率v(H2) = ________ ,达到平衡时氢气的转化率为________ 。
③该温度下的平衡常数表达式为________ 。
④下列的条件一定能加快反应速率并且提高H2转化率的是________(填代号)。
A.降低反应温度 B.分离出水
C.保持容器体积不变,充入稀有气体 D.保持容器体积不变,充入CO2气体
T℃时,pH = 2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示

(1)图中a点的值为
(2)若对上述硫酸再稀释10000倍则溶液中n (H+) :n(SO42-)=
(3)在T℃时,醋酸的电离平衡常数K=1.0×10-5, Kw=1.0×10-13则下列反应CH3COO-+H2O CH3COOH+OH-的平衡常数K= 。
CH3COOH+OH-的平衡常数K= 。
(4)在T℃时,取pH=2的硫酸溶液0.5Vml稀释到2Vml ,与0.1mol/L的NaOH溶液0.15Vml混合后稀释至10Vml,溶液的pH= 。
某温度下,容积同为2L的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知某温度下2HI(g)  H2 (g)+I2 (g) ΔH =+AkJ·mol-1 K=4.0)
H2 (g)+I2 (g) ΔH =+AkJ·mol-1 K=4.0)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
2 mol HI |
1 mol H2+1 mol I2 |
2 mol HI+1 mol H2 +1 mol I2 |
| HI的浓度 |
c1 |
c2 |
c3 |
| 反应的能量变化 |
吸收akJ |
放出bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
a1 |
a2 |
a3 |
(1)根据上表回答问题
①c1、c3的关系式为 ;②a、b的关系式为 ;
③p2、p3的关系式为 ;④a1与a2的关系式为 ;
(2)甲容器中:该反应的平衡常数表达式为 。
(3)乙容器中:反应在开始2分钟后达平衡状态,则该反应在这2分钟内用HI表示的平均反应速率为 mol·L ·min
·min
(4)丙容器中:反应开始时V正 V逆(填“小于”、“等于”或“大于”)
工业常用燃料与水蒸气反应制各H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4kJ·mol-1,下列判断正确的是_______。
CO(g)+H2(g) △H=+131.4kJ·mol-1,下列判断正确的是_______。
A.该反应的反应物总能量小于生成物总能量
B.标准状况下,上述反应生成IL H2气体时吸收131.4kJ的热量
C.若CO(g)+H2(g)  C(s)+H2O(l) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(l) △H=-QkJ·mol-1,则Q<131.4
D.若C(s)+CO2(g)  2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g)  H2(g)+CO2(g) △H2则:△H1+△H2="+131.4" kJ·mol-1
H2(g)+CO2(g) △H2则:△H1+△H2="+131.4" kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO.该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
己知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| |
不同时间各物质的物质的量/mol |
|||
| 0min |
2min |
4min |
6min |
|
| CH4 |
2.00 |
1.76 |
1.60 |
n2 |
| H2 |
0.00 |
0.72 |
n1 |
1.20 |
根据表中数据计算:
①0min~2min内H2的平均反应速率为_______。
②达平衡时,CH4的转化率为________。在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比______(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有______(填字母)
A.CO的含量保持不变
B.容器中c(CH4)与c(CO)相等
C.容器中混合气体的密度保持不变
D.3v正(CH4)=v逆(H2)
( 3 )合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如下图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过)。

①a电极的名称为________。
②写出除去甲醇的离子方程式____________
石油是一种极其重要的资源,是发展国民经济和国防建设重要物资。B的产量通常用来衡量一个国家的石油化工水平,A是生活中常见的有机物,易溶于水并有特殊香味。

Ⅰ.有关物质转化关系如图1所示:
(1)足量烃B通入溴水的实验现象是 。
(2)反应②属于 反应(填有机反应类型)。
(3)写出反应④的化学方程式 。
Ⅱ.某化学兴趣小组对反应③进行探究活动,设计如图2装置进行实验:
(4)在实验中球形干燥管除起冷凝外,另一个重要作用是 。
(5)反应结束后b中的现象是 。
A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性、B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水电离程度小于A2溶液中水电离程度,B1溶液中水电离程度小于B2溶液中的水电程度。
(1)写出化学式:Al :____;A2:___;Bl :___;B2:____
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为________
(3)写出0.l mol·L-1的A2溶液中离子浓度的大小排列______。
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是___________。
(5)若常温下B1、B2两溶液的pH = 5,则两溶液中水电离出的氢离子的物质的量浓度之比为_______。
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO 浓度如下表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K =______。
(2)前2s 内的平均反应速率v(CO2)=________。
(3)在上述条件下反应能够自发进行,则反应的△H___0(填写“>”、“<”、“=”)。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是____
A.反应混合物各组分物质的量浓度相等
B. NO 、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗lmolNO的同时,就有lmolCO生成
过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态.如图I是1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图。
(1)试写出NO2和CO反应的热化学方程式:____.该反应的活化能是___kJ·mol-1
(2) 图2 是某学生模仿图l画出的NO(g)+CO2(g)= NO2(g)十CO(g)的能量变化示意图。则图中E3=_kJ·mol-1,E4="____" kJ·mol-1
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
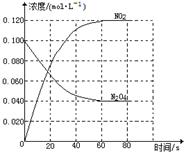
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1;反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T 100℃(填“大于”“小于”),判断理由是 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
(1)请结合必要的方程式,尝试从微粒的电荷情况和电离平衡的移动两方面解释为什么碳酸的分步电离一步比一步困难?(请用方程式并结合必要的文字来回答该小题)
(2)某温度(t℃)时,测得0.01 mol·L-1 NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw= 。
②此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(3)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;
H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于 _____ _____。
请设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论),要求仪器自选。
【供选择的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。】______ 。
化学在可持续发展和能源的综合利用作出了巨大贡献。煤、石油、天然气这些化石能源如何更好的综合利用,相关技术日益成熟,请回答下列问题:
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)  CO(g)+H2(g),此反应是吸热反应
CO(g)+H2(g),此反应是吸热反应
①此反应的化学平衡常数表达式为 ;
②下列能增大碳的转化率的措施是 ;(填写相应字母)
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
 (2)合成气合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g) △H=-90.8kJ· mol-1
(2)合成气合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g) △H=-90.8kJ· mol-1
T℃下此反应的平衡常数为160。此温度下,在2L密闭容器中开始只加入CO、H2,反应10min后测得各组分的物质的量如下:
| 物质 |
H2 |
CO |
CH3OH |
| 物质的量(mol) |
0.4 |
0.2 |
0.8 |
①该时间段内反应速率v(H2)= mol·L-1·min-1。
②比较此时正、逆反应速率的大小:v(正)_______v(逆)(填“>”、“<”或“=”)。
氧化还原反应与电化学及金属的防护知识密切相关。请回答下列问题:
(1)依据反应: 设计的原电池如图所示。
设计的原电池如图所示。
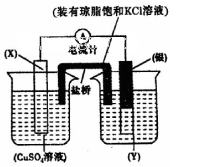
则电解质溶液Y是________________ (填化学式),X的电极反应式___________________,盐桥中的Cl-移向_______________溶液(填化学式)。若将盐桥换成铜丝,则X电极名称是____________。
(2) 利用下图的装置可以模拟铁的电化学防护:
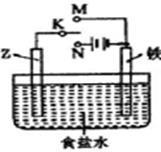
若Z为碳棒,为延缓铁腐蚀,K应置于____处,总反应的离子方程式为__________________ ;若Z为锌,开关K置于M处,该电化学防护法称为____________________。
25℃时,电离平衡常数:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.8×10﹣5 |
K1=4.3×10﹣7 K2=5.6×10﹣11 |
3.0×10﹣8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是: ;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是: ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c (OH﹣)/ c(H+)
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.
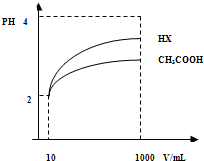
则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 ,
稀释后,HX溶液中水电离出来的c(H+) 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)= .(填准确数值).
(5分) 已知100℃ KW=10-12,若将此温度下pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积之比为 (写出计算过程)。