一包白色固体,可能含有CuSO4、Na2CO3、NaCl、CaCl2四种物质中的一种或几种,现进行如下实验:将此白色固体溶于水得到无色溶液,取上述溶液少许滴加盐酸有无色无味的气体产生,据此现象判断,原溶液中一定不含有的物质是 ,一定含有的物质是 ,可能含有的物质是 ,若要进一步鉴定是否含有该物质的方法是 。
(1)向NaHSO4溶液中逐渐加入Ba(OH)2溶液至中性,写出反应的离子方程式:______________________________________________。
(2)在以上中性溶液中,继续加入Ba(OH)2溶液至沉淀完全,此步的离子方程式为: ____________________________________________。
按要求书写下列离子方程式或化学方程式:
①写出Ba(NO3)2溶液中加稀H2SO4的离子方程式: 。
②写出将铁屑加入CuSO4溶液中的离子方程式: 。
③将Cu2++2OH-=Cu(OH)2↓改写成化学反应方程式: 。
④将CO32-+2H+=CO2↑+H2O改写成一个化学反应方程式: 。
汽车尾气中的主要污染物是 及燃料不完全燃烧所产生的 。前者产生的原因是(用化学方程式表示) 。经计算,反应2NO (g)+2CO(g)=N2(g)+2CO2(g)的△H-T△S<0,即这一反应应该是自发进行的,为什么常温常压下大气中的NO和CO不能转化为N2和CO2而净化?
。
(安徽省合肥八中2008—2009学年度高三第二次月考,化学,18)用6mol·L-1的硫酸配制100mL1.0mol·L-1硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.20mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号) 。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号) 。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm~2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
(3)怎样检查容量瓶是否漏水 。
从石油化工产品中任选一种三个碳的烃为唯一碳源和有关物质为原料合成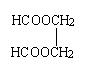
二甲酸乙二酯,( )写出各步反应的化学方程式。(可不注明反应条件)
已知: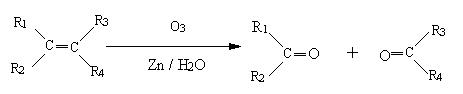
(R1、R2、R3、R4、可代表烃基,也可代表氢原子)
⑴ 。
⑵ 。
⑶ 。
⑷ 。
⑸ 。
⑹ 。
⑺ 。
下列实验操作或事故处理中,不正确的做法是
| A.利用气球或球胆将有毒气体收集后,另作处理,避免其逸散到空气中,污染环境。 |
| B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒 |
| C.酸、碱溅在眼中,立即用水反复冲洗,并不断眨眼和揉眼 |
| D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度 |
E.不慎将浓硫酸沾在皮肤上,立即用NaOH溶液冲洗
F.汞洒落地面,应立即撒上一层硫磺粉
G.银镜反应实验后附有银的试管,可用氨水清洗
H.为了测定某溶液的pH,将用蒸馏水润湿的pH试纸浸入到待测溶液中,过一会取出,与标准比色卡进行对比
I.误服重金属盐,可服用大量的牛奶、蛋清或豆浆解毒
四种元素、
、
、
位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;
原子的
层
轨道中有2个电子;
与
原子的价层电子数相同;
原子的
层电子数与最外层电子数之比为4:1,其
轨道中的电子数与最外层电子数之比为5:1。
(1)、
可分别与
形成只含一个中心原子的共价化合物
、
,它们的分子式分别是、; 杂化轨道分别是、;
分子的立体结构是。
(2)的最高价氧化物和
的最高价氧化物的晶体类型分别是晶体、晶体:
(3)的氧化物与
的氧化物中,分子极性较小的是(填分子式);
(4)与
比较,电负性较大的, 其+2价离子的核外电子排布式是
已知单质铁和硫粉反应时需用酒精灯加热,反应方能开始,但在铁粉和硫粉开始反应后,把酒精灯撤去反应仍可进行完全。则此反应为 反应(填“放热”、“吸热”)。原因是 。
将除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生H2的速率变化情况如下图所示。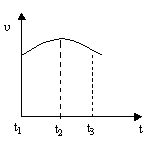
图中t1~t2速率变化的主要原因是______ ____ _,t2~t3速率变化的主要原因是 _。
某温度下,在2 L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示。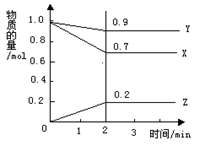
由图中数据分析:该反应的化学方程式为: 。反应开始至2 min ,Z的平均反应速率为 。
某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用。其结构简式如下: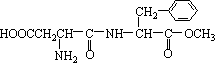
已知:①在一定条件下,羧酸酯或羧酸与含—NH2的化合物反应可以生成酰胺,如:
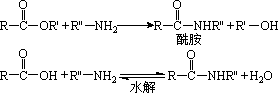
②酯比酰胺容易水解。
请填写下列空白:
(1)在稀酸条件下加热,化合物A首先生成的水解产物是_________和___________
(2)在较浓酸和长时间加热条件下,化合物A可以水解生成:_________、_________和___________
(3)化合物A分子内的官能团之间也可以发生反应,再生成一个酰胺键,产物是甲醇和________(填写结构简式,该分子中除苯环以外,还含有一个6原子组成的环。)
(1)具有支链的化合物A的分子式为C4H9O2,A可以使Br2的四氯化碳溶液褪色。1 mol A和1 mol NaHCO3能完全反应,则A的结构简式是 。写出与A具有相同官能团的A的所有同分异构体的结构简式
(2)化合物B含有C、H、O三种元素,相对分子质量为60,其中碳的质量分数为60%,氢的质量分数为13.3%。B在催化剂Cu的作用下被氧气氧化成C,C能发生银镜反应,则B的结构简式是
(3)D在NaOH水溶液中加热反应,可生成A的钠盐和B,相应反应的化学方程式是
近年来,乳酸CH3CH(OH)COOH成为人们的研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。乳酸有许多用途,其中利用乳酸的聚合而合成的高分子材料,具有很好的生物兼容性,它无论在哺乳动物体内或自然环境中,最终都能够降解成为二氧化碳和水。请回答下列有关问题:
(1)乳酸在发生下列变化时所用的试剂是① ②

(2)乳酸可以跟精制的铁粉反应制备一种补铁的药物,反应的化学方程式为:
2CH3CH (OH) COOH+Fe→[CH3CH(OH)COO]2Fe+H2↑
该反应中氧化剂是 ,还原产物是
(3)由乳酸可以制取  ,请写出设计合成实验时所涉及的有机反应类型 。
,请写出设计合成实验时所涉及的有机反应类型 。
(4)聚乙烯、聚苯乙烯材料因难分解而给人类生存环境带来严重的“白色污染”,德国Danone公司开发了聚乳酸材料  ,它是由乳酸通过 反应制取的。聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式 ,
,它是由乳酸通过 反应制取的。聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式 ,
(5)若碳原子以单键与四个不同的原子或原子团相结合,则称该碳原子为“手性碳原子”,含有手性碳原子的分子称为“手性分子”,手性分子往往具有一定生物活性。乳酸分子是手性分子,乳酸[③CH3②CH(OH)①COOH]的手性碳原子是 号碳原子。
(6)乳酸的某种同分异构体具有下列性质:能发生银镜反应;1 mol该物质跟足量金属钠发生缓慢反应,生成2g氢气;该分子为手性分子。写出该物质的结构简式