常温下,一种烷烃A和一种单烯烃B组成混合气体,A或B分子中最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
⑴将1L该混合气体充分燃烧,在同温同压下得到2.5LCO2气体。试推断原混合气体中A和B所有可能的组合及其体积比,并将结果填入下表:
| 组合编号 |
A的分子式 |
B的分子式 |
A、B的体积比 |
| ① |
|
|
|
| ② |
|
|
|
| ③ |
|
|
|
| ④ |
|
|
|
⑵120℃时取1L该混合气体与9LO2混合,充分燃烧,当恢复到120℃和原压强时,体积增大6.25%,试通过计算确定A、B的分子式。
将22.4g铜粉与三氧化二铁的混合粉末,加入1mol/L的硫酸中进行反应。
(1)若固体恰好全部溶解,消耗硫酸的体积为VL,求V的取值范围。
(2)若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中Fe2+的浓度为0.1mol/L,求此混合物中含铜多少克?
钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的
溶液,充分反应后,过滤、洗涤、灼烧得4.80
。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00
生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(2)取某钢样粉末28.12(假设只含
和
),在氧气流中充分反应,得到
气体224
。(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到l00相同浓度的
。溶液中,充分反应后,测得的实验数据如下表所示:
| 实验序号 |
I |
Ⅱ |
Ⅲ |
| 加入钢样粉末的质量/ |
2.812 |
5.624 |
8.436 |
| 生成气体的体积/ |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度。
③若在实验Ⅱ中继续加入钢样粉末,计算反应结束后剩余的固体质量为多少?(用含
的代数式表示)
40mL 2mol/L的NaOH 溶液和40mL 2mol/L 的盐酸在19℃时混合,混合后测得溶液的温度为32.6℃。求反应的中和热[混合后溶液的比热容c =" " 4.18 J/(g·℃)]。
完全燃烧甲酸、乙酸和乙二酸的混合酸m g后,恢复到标准状况下得到2.24 L二氧化碳气体。如果完全中和上述m g混合酸,需要1 mol·L-1的氢氧化钠溶液80 mL。试通过计算求出原混合酸m g的取值范围。
实验证实,烯烃被酸性高锰酸钾溶液氧化时有如下规律:

已知某烃在通常情况下,只能跟等物质的量的溴反应;它与酸性高锰酸钾溶液反应时,所得的氧化产物只有一种没有取代基。又知该烃完全燃烧时所需氧气的体积是相同情况下烃蒸气的8.5倍。试通过计算求出该烃及其氧化产物的结构简式(要求写出计算及推导过程)。
在铁和氧化铁的混合物15g中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH溶液200mL。求:
①混合物中铁和氧化铁各多少克?
②稀H2SO4的物质的量浓度为多少?
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 |
HA的物质的量 浓度(mol·L-1) |
NaOH的物质的量 浓度(mol·L-1) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A—)和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
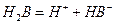

回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2—)+c(HB—)=0.1mol/L B.c( B2—)+ c(HB—)+c(H2B)=0.1mol/L
C c(OH—)=c(H+)+ c(HB—) D.c(Na+)+c(OH)=c(H+)+ c(HB—)
古有“杜康酿酒反为醋”的传说,高粱、玉米等粮食是酿酒工业的主要原料。粮食发酵可得有机化合物A,在A分子中碳的质量分数为52.2%,氢的质量分数为13.0%,其余为氧元素。又知A在一定条件下可生成B,在加热和浓硫酸作用下,A与B反应可生成一种有香味的物质C,若184gA和120gB反应能生成106gC,计算该反应的产率(写出计算过程)。
生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通入足量的澄清石灰水中,充分反应吸收,生成沉淀8.5g,则:
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通入足量的澄清石灰水中,充分反应吸收,生成沉淀8.5g,则:
(1)原混合气体中甲烷的物质的量是 。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12氢气(标准状况),此时测得铝箔质量比反应前减少了0.27
,水槽和容器内溶液的总体积为2.0
,溶液中
的浓度为0.050
-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
标准状况下,1体积水吸收500体积NH3后,所得氨水密度为0.9g·cm-3,求氨水中溶质的质量分数和氨水的物质的量浓度各为多少?
在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时压强增加了75%。则A单质的一个分子中有_______个A原子,AH3分解反应的化学方程式为__________________________________________。
化合物KxFe(C2O4)y·zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.491g两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3mol/LH2SO4和适量的蒸馏水,加热到75℃,趁热加入0.0500mol/L KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+完全转化为Fe2+,该溶液中Fe2+刚好与4.0mL 0.0500mol/L KMnO4溶液完全反应。通过计算,分别求:
(1)0.491g样品中结晶水的物质的量。
(2)化合物中草酸根的质量分数。
(3)化合物的化学式。
已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O