用铂作电极电解某金属的氯化物(XCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g,求:(不要求计算过程)
(1)该金属的相对原子质量;
(2)电路中有多少电子通过?
空气污染监测仪是根据二氧化硫与溴水的定量反应来测定空气中的二氧化硫含量的。
SO 2 +Br 2 +2H 2 O  2HBr+H 2 SO 4
2HBr+H 2 SO 4
上述反应的溴来自一个装有酸性(H 2 SO 4 )KBr溶液的电解槽阳极上的氧化反应。电解槽的阳极室与阴极室是隔开的。当测定某地区空气中SO 2 含量时,空气(已除尘)以1.5×10 -4 m 3·min -1 的流速进入电解槽的阳极室,电流计显示电子通过的速率是8.56×10 -11 mol·s -1 ,此条件下能保持溴浓度恒定并恰好与SO 2 完全反应(空气中不含能与溴反应的其他杂质)。写出上述材料中监测过程中发生的主要的化学反应方程式及该地区空气中SO 2 的含量(g·m -3 )。
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2+ 3H2 2NH3。
2NH3。
(1)若反应进行5min时,测得n(N2) = 1.8mol,n(NH3) = 0.4mol。
计算:①a的值; ②用H2浓度的变化表示的反应速率。
(2)反应达平衡时,混合气体的总物质的量为5.0mol,其中NH3的含量(体积分数)为40%。
计算:上述温度下该反应的化学平衡常数。
某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为180。取有机物样品1.8g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g。试求该有机物的分子式。
已知实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
(1)标准状况下生成Cl2的体积。
(2)反应生成的MnCl2的质量为。
某结晶水合物,含有两种阳离子和一种阴离子,其中所含元素均为短周期元素。为确定其组成,有同学进行了如下实验:称取9.06 g样品,溶于水,将溶液分成两等份,待用。
①向一份溶液中逐滴加入6 mol·L-1 NaOH溶液,先观察到有白色沉淀产生,而后产生使湿润的红色石蕊试纸变蓝色的气体,继续滴加NaOH,白色沉淀又逐渐消失,最后得到无色透明溶液。向其中加入足量BaCl2溶液,可得不溶于稀盐酸的白色沉淀4.66 g。
②取另一份溶液,加入足量6 mol·L-1 NaOH溶液,加热,收集到标准状况下的气体224 mL。然后,往溶液中通入足量CO2,过滤,将所得沉淀洗涤、烘干、灼烧,得白色固体0.51 g。
请回答:
(1)该结晶水合物中含有的两种阳离子是 、 ;一种阴离子是 。
(2)试通过计算确定该结晶水合物的化学式,请写出计算过程。
已知25℃时,Ksp(Mg(OH)2)=1.8×10-11,Ksp(Cu(OH)2)=2.2×10-20。请按要求回答下列问题:
(1)在25℃下,向浓度均为0.1 mol・L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____________沉淀(填化学式),生成该沉淀的离子方程式为________________。
(2)25℃时,向0.01 mol・L-1的MgCl2溶液中,逐滴加入浓NaOH溶液,当Mg2+完全沉淀时,溶液的pH为_______________(忽略溶液体积变化,已知lg1.8=0.26)。
(3)已知25℃时,Ksp(Fe(OH)3)=2.79×10-39,试求该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K,写出计算推理过程。
Fe3++3H2O的平衡常数K,写出计算推理过程。
某温度下,在装有催化剂的容积为2L的反应容器中,充入SO2和O2各4mol,充分反应5min后达到平衡,测得反应容器内混合气体的压强为原来的80%,回答下列问题:
(1)用O2的浓度变化表示该反应的化学反应速率。
(2)求混合气体中,SO3的物质的量分数。
(3)求SO2的转化率。
聚合硫酸铝铁[AlaFeb(OH)n(SO4)m·xH2O]是一种新型高效净水剂,广泛应用于工业污染水的处理。
(1)聚合硫酸铝铁能够净水的原因是
(2)AlaFeb(OH)m(SO4)n•xH2O中a、b、m、n的代数关系式为_______________________。
(3)为了测定聚合硫酸铝铁的组成,进行如下实验:
步骤一:准确称取8.810g样品溶于150mL 0.100mol•L-1稀硫酸,恰好完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体10.485g;
步骤二:另取相同质量的样品,溶于过量的氢碘酸,以磁力搅拌机搅拌,充分反应后,以0.500mol•L-1Na2S2O3溶液滴定至浅黄色,滴入几滴淀粉溶液,再滴定至终点,消耗Na2S2O3溶液20.00mL.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
①步骤二中使用磁力搅拌器进行搅拌的目的是________________________。
②通过计算确定聚合硫酸铝铁的化学式(写出计算过程)。
准确称取22.7g某矿石样品(含Al2O3、Fe2O3和不溶于水和酸的杂质),放入盛有100mL某浓度的硫酸的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如下图所示。请回答:
(1)硫酸的物质的量浓度是多少?
(2)若a=10,矿石样品中Fe2O3的质量是多少?
(3)试计算a的取值范围。
过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
(1)称取0.542g过氧化钙样品,灼热时发生如下反应: 2CaO2·XH2O  2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
① 试计算样品中CaO的质量。
② 试计算样品中CaO2·XH2O的X值。
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)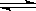 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol·L-1·min-1。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol·L-1·min-1。求:
(1)x值;
(2)B的平均反应速率;
(3)此时A的浓度及反应开始前放入容器中的A、B的物质的量。
将N2和 H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:
(1)反应前混合气体中N2和 H2的体积比;
(2)达到平衡时混合气体中的氨的体积分数;
(3)平衡时N2的转化率。